МИКРОБИОМ ЧУВСТВИТЕЛЬНОЙ КОЖИ: ОСОБЕННОСТИ И НОВЫЕ ДАННЫЕ
27.10.2020
Микробиом кожи — совокупность микроорганизмов, ее населяющих, играет существенную роль в поддержании здоровья кожи. Основную часть «здорового» микробиома составляют бактерии семейств Actinobacteria, Proteobacteria, Firmicutes и Bacteroidetes, среди грибов доминирует род Malassezia, живут там и клещи Demodex, что касается вирусов — они также присутствуют, хотя этот вопрос пока наименее изучен (Byrd A.L. et al., 2018). Состав микробиома напрямую зависит от состояния кожи — липидов, которые выделяются на ее поверхность (и служат основным источником питания микроорганизмам), рН, количества воды, микроэлементов и т.д.
До сих пор точно неизвестно, являются ли качественные и количественные изменение состава микробиома причиной или следствием различных кожных заболеваний (и в большинстве случаев это скорее двухсторонний процесс), но они зафиксированы при многих распространенных патологиях: акне, атопическом дерматите, псориазе, розацеа и т.д.
И это влияние связано не только с развитием воспалительных элементов, но и непосредственным влиянием на кожный барьер (Baldwin H.E. et al., 2017). Недавние исследования показали, что как разнообразие микробиома, так и относительное преобладание некоторых «хороших» микроорганизмов над условно патогенными, играет роль в формировании здорового барьера, а изменение этих показателей (обеднение или смещение пропорций) наоборот — обусловливает нарушение его нормальной структуры и функции. При этом ученые все больше сходятся в том, что нет типичных микробиомов при тех или иных заболеваниях, сообщества могут меняться индивидуально. Перефразировав первое предложение знаменитого романа Льва Толстого «Анна Каренина» — «все счастливые семьи похожи друг на друга, каждая несчастливая семья несчастлива по-своему», ученые сделали его слоганом своей новой концепции, которую назвали гипотезой Анны Карениной — «все здоровые микробиомы похожи друг на друга, но каждый нездоровый микробиом нездоров по-своему» (Ma Z.S., 2020). При этом чем сильнее изменяется состав микробиома (отклоняется от сбалансированного состояния), тем сильнее ухудшается функция кожного барьера (Yuan C., et al., 2020).
Разумеется, ученые не могли пройти мимо вопроса микробиома при синдроме чувствительной кожи. Как известно, нарушение проницаемости кожного барьера является одним из патогенетических механизмов данного состояния. Поэтому дисбиоз, приводящий к соответствующей проблеме, может повышать чувствительность кожи. Кроме того, за взаимодействие с микробиомом отвечает наша врожденная иммунная система. Ключевую роль во врожденном иммунитете играют толл-подобные рецепторы (Toll-like receptor, TLR) — в коже это TLR2, и кателицидиновый путь (Kligman A.M., 2004).
Толл-подобные рецепторы 2 типа — это класс трасмембранных клеточных рецепторов, детектирующая часть которых расположена на поверхности эпителиальных клеток (в том числе кератиноцитов) и клеток иммунной системы (моноцитов/макрофагов, нейтрофилов, дендритных и тучных клеток). При их контакте с различными структурами микроорганизмов, происходит активация рецепторов и запуск иммунного ответа уже внутри клетки — цепочки реакций с высвобождением провоспалительных цитокинов, хемокинов, протеаз и проангиогенных факторов, направленных на борьбу с чужеродным патогеном. Центральным звеном данной борьбы является антимикробный пептид кателицидин (CAMP) и его активная форма — пептид LL-37, действие которого связано с усилением воспаления в коже, расширением сосудов и их пролиферацией через фактор роста эндотелия сосудов (VEGF), усилением хемотаксиса нейтрофилов, а также дисрегуляции синтеза компонентов внеклеточного матрикса (Tan J., et al., 2013, Scheenstra M.R., et al., 2020).
TLR2 рецепторов много в том числе и на тучных клетках, при дегрануляции которых происходит выброс гистамина, обусловливающего ощущение зуда (Igawa S. et al., 2017). Кроме этого, они обнаруживаются и на свободных нервных окончаниях — волокнах, обусловливающих восприятие боли и зуда (Liu T. et al., 2012). И это в дополнение к имеющимся там TRP-каналам — особым рецепторам, которые непосредственно отвечают за восприятие различных химических, физических и механических раздражителей, и могут активизироваться как под действием агентов кателицидинового сигнального пути, так и агентов иммунных клеток.
В состоянии баланса микробиома иммунная система не проявляет агрессивных реакций в отношении своих «хороших» соседей, однако при изменении его состава — начинает реагировать. В итоге это приводит к развитию воспалительных реакций, зуда и болевых ощущений. В некоторых случаях воспаление может быть не особо выражено, однако при имеющейся у людей с чувствительной кожей гиперреактивности нервных волокон, дисбаланс микробиома вполне может проявляться появлением неприятных симптомов повышенной чувствительности кожи.
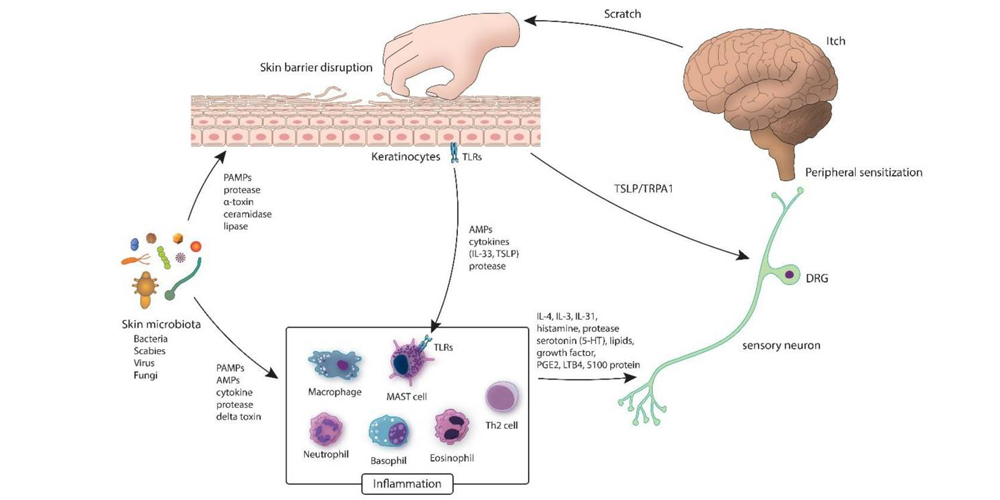
Как дисбаланс микробиома может приводить к возникновению зуда (Kim H.S. et al., 2020).
Исследований по непосредственному изучению состава микробиома чувствительной кожи пока мало. В одних обнаруживается некоторый дисбаланс, другие не выявили никаких особых отличий микробного состава чувствительной и нечувствительной кожи (Hillion M. et al., 2013). Однако одна из недавних работ показала довольно интересные результаты — ученые обнаружили, что несмотря на условно сопоставимый бактериальный состав чувствительной и нечувствительной коже, существуют отличия в микобиоме, т.е. в грибковом составе. Наряду со снижением числа Malassezia restricta — основного представителя рода Malassezia на коже, наблюдалось увеличение разнообразия других грибов. Кроме того, отмечалось изменение «контролирующих» взаимодействий между микроорганизмами (Keum H.L. et al., 2020)
Еще один интересный аспект — связь чувствительности кожи с составом микробиома кишечника. Недавние исследования указывают на роль кишечного микробиома в висцеральной гиперчувствительности, тревоге и депрессии, и подтверждают концепцию, согласно которой микробный дисбаланс может способствовать развитию и сохранению симптомов синдрома раздраженного кишечника (Distrutti E. et al., 2016). Кроме того, микробиом кишечника влияет на двунаправленную коммуникацию между кишечной нервной системой и центральной нервной системой, модулируя развитие кишечника и некоторые физиологические функции, включая перистальтику кишечника, чувствительность, секрецию и иммунитет. Таким образом, косвенно активация иммунной системы и выработка провоспалительных цитокинов могут влиять на кожу. Это подтверждает и недавнее исследование с участием 5000 человек, 13,6% из которых страдали синдромом раздраженного кишечника, а 59,1% заявили о том, что у них чувствительная кожа. При этом в данное количество людей с чувствительной кожей входило 73,2% людей с синдромом раздраженного кишечника по сравнению с 56,9% людей без соответствующего заболевания. Таким образом, синдром раздраженного кишечника чаще встречался у людей с более выраженной чувствительностью кожи (Seite S. et al., 2018).
Более подробно о чувствительной коже — новых данных о ее патогенезе и современных возможностях терапии, вы можете прочитать в книге из серии «Моя специальность — косметология» «Чувствительная кожа в практике косметолога», которая уже очень скоро появится в продаже. Следите за нашими обновлениями!
Источники:
Baldwin H.E., Bhatia N.D., Friedman A., Eng R.M., Seite S. The Role of Cutaneous Microbiota Harmony in Maintaining a Functional Skin Barrier. J Drugs Dermatol. 2017 Jan 1;16(1):12-18. PMID: 28095528.
Ma Z.S.. Testing the Anna Karenina Principle in Human Microbiome-Associated Diseases. iScience. 2020 Apr 24;23(4):101007.
Byrd A.L., Belkaid Y., Segre J.A. The human skin microbiome. Nat Rev Microbiol. 2018 Mar;16(3):143-155.
Yuan C., Ma Y., Wang Y. et al. Rosacea is associated with conjoined interactions between physical barrier of the skin and microorganisms: A pilot study [published online ahead of print, 2020 May 17]. J Clin Lab Anal. 2020;e23363
Liu T., Gao Y.J., Ji R.R. Emerging role of Toll-like receptors in the control of pain and itch. Neurosci Bull. 2012;28(2):131-144.
Igawa S., Di Nardo A. Skin microbiome and mast cells. Transl Res. 2017 Jun;184:68-76.
Kim H.S., Yosipovitch G. The Skin Microbiota and Itch: Is There a Link?. J Clin Med. 2020;9(4):1190.
Hillion M., Mijouin L., Jaouen T. et al. Comparative study of normal and sensitive skin aerobic bacterial populations. Microbiologyopen. 2013;2(6):953-961.
Keum H.L., Kim H., Kim H.J. et al. Structures of the Skin Microbiome and Mycobiome Depending on Skin Sensitivity. Microorganisms. 2020;8(7):1032.
Distrutti E., Monaldi L., Ricci P. Fiorucci S. Gut microbiota role in irritable bowel syndrome: New therapeutic strategies. World J Gastroenterol. 2016;22(7):2219-2241.
Seite S., Misery L. Skin sensitivity and skin microbiota: Is there a link? Exp Dermatol. 2018 Sep;27(9):1061-1064.