ТОНКАЯ РАБОТА: КОРРЕКЦИЯ ВОЗРАСТНЫХ ИЗМЕНЕНИЙ КОЖИ НА ДЕРМАЛЬНОМ И СУБДЕРМАЛЬНОМ УРОВНЯХ ПРИ ПОМОЩИ РАДИОЧАСТОТНОЙ МИКРОИГОЛЬЧАТОЙ ТЕРАПИИ
06.12.2022
ФЛЕГОНТОВА Елена Александровна
К.м.н., дерматокосметолог, физиотерапевт, генетический консультант, руководитель обучающих программ в ООО "КИТ МЕД", преподаватель и куратор программ в Global Academy
КРЕЙНДЕЛЬ Михаил
Доктор технических наук, технический директор и основатель InMode Ltd. (Израиль)
По мере старения структура нашей кожи меняется. Эпидермальный слой становится тоньше из-за атрофических изменений кератиноцитов. Это приводит к усилению трансэпидермальной потери воды и повышению сухости кожи. Компоненты внеклеточного матрикса — коллаген и эластин, которые обеспечивают прочность на растяжение и эластичность кожи соответственно, — в процессе старения претерпевают существенные изменения (рис. 1) [1].

Наблюдается общее снижение количества коллагена за счет уменьшения активности синтеза, а также усиления его фрагментации, что, предположительно, связано с повышенной экспрессией матриксных металлопротеиназ (matrix metalloproteinase; MMP) в стареющей коже [2]. В настоящее время описано около 28 типов коллагена, которые кодируются более чем 40 генами. В коже преобладает коллаген I типа (80–90% всего коллагена кожи) и коллаген III типа. Уровень коллагена III типа повышается во время заживления ран или активации неоколлагеногенеза. Коллаген IV типа образует плоскую сеть на границе эпидермиса и дермы, участвуя в формировании базальной мембраны. Коллаген V типа объединен в фибриллах с коллагеном I и III типов. Он помогает регулировать диаметр волокон. Важную функцию выполняет коллаген VII типа — основной компонент якорных фибрилл, обеспечивающих адгезию между эпидермисом и нижележащей дермой [3]. Якорные фибриллы предохраняют кожу от чрезмерного растяжения.

Эластин является важным белком кожи, состоящим из молекул тропоэластина с поперечными сшивками. Эластин соединяется с микрофибриллами, образуя эластиновые волокна, которые обеспечивают растяжимость и упругость кожи (рис. 2) [4–7].
Эластиновые волокна расположены в дермальном слое. Там они формируют сложную сеть, ориентируясь как перпендикулярно, так и параллельно поверхности кожи. В коже взрослого человека на долю эластиновых волокон приходится от 2 до 4% обезжиренного сухого веса [4].
В основном эластиновые волокна состоят из эластина и фибриллина. Особенности состава эластиновых волокон обусловливают различия в упругости кожи. Например, ретикулярный и сосочковый слои дермы содержат эластиновые волокна, которые различаются по своей толщине, ориентации и относительному составу эластина, фибриллина и других веществ. Высокое содержание короткоцепочечных гидрофобных аминокислот в тропоэластине в сочетании с водой способствует повышению эластичности и упругости кожи [5].
В процессе старения происходит разрушение сети эластиновых волокон, что приводит к снижению регенеративной способности, структурным повреждениям и нарушению гомеостаза. Следует отметить, что по ряду причин именно эластин оказывается особенно уязвим к действию неблагоприятных внутренних и внешних факторов.
Вырабатывается эластин в раннем возрасте и в течение жизни практически не восполняется, поэтому любые изменения эластиновых волокон, которые происходят в течение жизни, имеют тенденцию быть постоянными [6, 7]. Период полураспада эластина составляет примерно 70 лет. Следовательно, в течение жизни синтезируется очень небольшое количество этого белка — обновление эластина происходит крайне медленно. Подсчитано, что только около 1% пептидов эластина обновляется за десятилетие [8].
С течением времени (в процессе хроностарения) эластин подвергается повреждению и деградации. Это происходит из-за связанной со старением повышенной активности протеаз в богатых эластином тканях, что приводит к деградации эластина и одновременно к повышенной склонности к кальцинозу [9]. Во-первых, эластиновые волокна укорачиваются и фрагментируются и, во-вторых, происходит накопление повреждений эластина за счет модификации остатков аспарагиновой кислоты, накопления кальция и липидов, а также перекрестных сшивок с участием глюкозы. О деградации сети эластиновых волокон также может свидетельствовать нарушение взаимодействия с другими компонентами дермы, включая гиалуронан, версикан и элафин [10].
Из-за чрезвычайно медленного обновления деградация эластиновых волокон является практически необратимым и непоправимым явлением [11, 12]. Изменение ультраструктуры и количества эластиновых волокон драматично сказывается на состоянии кожи — происходят снижение ее эластичности и формирование классических возрастных изменений в виде морщин.
Особенно стремительно возрастные изменения эластиновых волокон прогрессируют при сочетании хроностарения со стойким воздействием ультрафиолетового (УФ) излучения (рис. 3, 4) [4, 11, 13]. Исследования in vivo и in vitro показали, что УФ-излучение активирует промоутер эластина, происходят качественные и количественные изменения эластиновых волокон с массивным отложением утолщенных, спутанных и аморфных волокон (солнечный эластоз). Этому явлению также способствует образование свободных радикалов, которые стимулируют синтез и накопление аномальных эластиновых волокон [14].


Таким образом, в основе возрастного изменения упругости, эластичности и микрорельефа кожи лежат значительные нарушения структуры и пространственного расположения соединительнотканных волокон дермы, обусловленные хроно- и фотостарением.
Существует множество подходов к повышению уровня коллагена и гиалуроновой кислоты в коже, но нет утвержденных методов терапии, которые достоверно увеличивают выработку эластина. Это связано с тем, что эластогенез представляет собой сложный процесс, включающий сшивку мономеров тропоэластина и микрофибриллярных белков с образованием эластиновых волокон. Этот процесс гораздо труднее стимулировать и регулировать, чем неоколлагеногенез, из-за множества этапов, связанных с процессом сборки.
Одним из самых мощных стимулов к запуску процесса ремоделирования дермального слоя служит контролируемое повреждение. С этой целью в аппаратной косметологии применяются различные физические факторы, среди которых в последнее время одним из наиболее востребованных служит электрический ток.
Применение радиочастотного тока в эстетической медицине
В эстетической медицине более широкое применение нашел переменный радиочастотный (radiofrequency; RF) электрический ток. Проходя через ткани, RF-ток вызывает колебания молекул тканей на своем пути с частотой 1 000 000 Гц. В результате микроосцилляций молекул тканей, межмолекулярного и внутримолекулярного движения образуется кинетическая энергия, переходящая в термическую. Нагрев тканей может происходить до высоких температур и носить аблятивный характер, при меньшем температурном показателе — неаблятивный. В последнем случае термостимуляция индуцирует воспаление, запускающее неоколлагеногенез, неоэластогенез и выработку основного вещества соединительной ткани. Ведущей задачей в этом процессе является обеспечение прицельного дозированного нагрева структур-мишеней в условиях максимально деликатного воздействия на окружающие ткани [15].
За последние 15 лет радиочастотная технология претерпевает стремительное развитие. Меняя конфигурацию и размер электродов, можно управлять плотностью потока энергии и, как следствие, модулировать желаемые эффекты.
Большинство методов контролируемого повреждения в эстетической косметологии сфокусированы на дермальном слое. Однако на пути между электродом и дермой располагается своеобразный барьер — эпидермальный слой, термическое повреждение которого влечет за собой повышенный риск осложнений и необходимость в реабилитационном периоде.
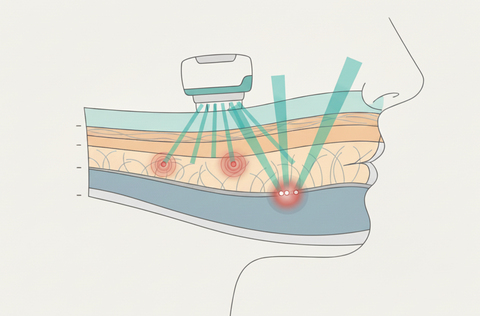
Препятствия часто служат стимулом к развитию. Так и в этом в процессе создания инструмента для точного радиочастотного воздействия возникла радиочастотная микроигольчатая терапия: электроды приобрели очертания микроигл. Уровень радиочастотного воздействия при этом зависит от длины электродов, а также типа покрытия.
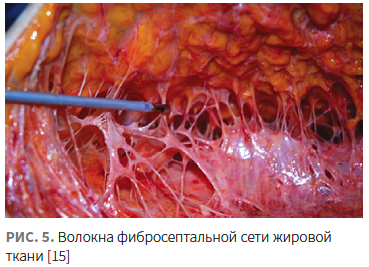
Новые технические возможности позволили сфокусировать RF-энергию на еще одной мишени — подкожно-жировом слое — и переосмыслить его роль в общем сокращении мягкий тканей. Подкожно-жировой слой делится на дольки посредством соединительнотканных перегородок, формирующих фибросептальную сеть (ФСС) и затем проникающих в дерму (рис. 5).
Положительно заряженные игольчатые электроды аппликатора вводятся на необходимую глубину и испускают RF-ток лишь со своего кончика. В тканях при этом формируются три зоны термического повреждения — зона абляции, зона обратимой коагуляции (при введении в жировой слой эти зоны обусловливают сокращение ФСС), а также большая зона некоагуляционного, неаблятивного нагрева ткани (рис. 6) [15].

После аблятивного повреждения жировой ткани RF-ток течет вверх к отрицательному возвратному электроду на поверхности кожи, деликатно нагревая дерму и эпидермис — подобная термостимуляция служит стимулом для образования новых компонентов межклеточного матрикса [15, 16].
Согласно наблюдениям Hantash B.M. и соавт., на тканевом уровне в ответ на проведение радиочастотной микроигольчатой терапии в тканях активируются процессы синтеза коллагена, эластина и гликозаминогликанов. Особо значимые изменения наблюдаются в отношении запуска неоэластогенеза: на 28-й день после проведения радиочастотной микроигольчатой терапии авторы отметили пятикратное увеличение уровня тропоэластина, на 10-й нед было зафиксировано значительное повышение содержания эластина в дермальном слое [17].
При RF-воздействии на уровне подкожно-жирового слоя происходят укорочение горизонтальных, косых, вертикальных соединительнотканных волокон ФСС, а также нагрев, сокращение и компактизация жировой ткани. Согласно научным публикациям Mulholland S., при комбинации RF-технологий (радиочастотно-ассистированной липосакции RFAL и радиочастотной микроигольчатой терапии) сокращение мягких тканей и уплотнение кожи после RF-воздействия может составить 35–70% (30–40% за счет ФСС + 20–30% за счет дермы и гиподермы) [15].
Восстановление упругости и эластичности кожи посредством аппликатора Morpheus8 — что говорит гистология?
Для комплексного воздействия на мягкие ткани компания InMode разработала фракционный радиочастотный аппликатор Morpheus8.
Это радиочастотное устройство с возвратно-поступательным механизмом введения микроигольчатых электродов обеспечивает биполярное радиочастотное неаблятивное ремоделирование дермы и коагуляцию подкожно-жирового слоя.
Каждый позолоченный игольчатый электрод Morpheus8 имеет силиконовое покрытие, за исключением дистальных 500 мкм — именно с кончика электрода и происходит испускание RF-энергии. Поток энергии направлен от кончиков микроигл к внешним электродам, прилегающим к поверхности кожи. Запатентованный импульс RF-энергии коагулирует субдермальную жировую ткань и, что важно, укорачивает горизонтальные, косые, вертикальные соединительнотканные волокна ФСС (рис. 7). Сокращение ФСС обеспечивает значительное уплотнение мягких тканей и устранение вышележащих морщин, рубцов, неровного рельефа кожи, пор, даже растяжек и рубцов постакне.
Затем RF-энергия направляется вверх вдоль микроигл с силиконовым покрытием и вдоль ФСС к отрицательно заряженным ромбовидным электродам на поверхности кожи, которые окружают игольчатые электроды. Это обеспечивает неаблятивный, субнекротический нагрев папиллярной и ретикулярной дермы, стимулирующий выработку нового коллагена, эластина и гликозаминогликанов.
Таким образом достигаются аблятивное повреждение мягких тканей на подкожном уровне и защита поверхностных слоев кожи от термического повреждения. Благодаря ограничению термического воздействия и защите дермоэпидермального соединения (область, где расположены меланоциты) удается минимизировать риск поствоспалительной гиперпигментации.
Морфологическая характеристика редукции возрастных изменений кожи под действием аппликатора Morpheus8
Для оценки изменений структуры кожи после радиочастотной микроигольчатой терапии Morpheus8 нами было проведено клиническое исследование с участием пациентов двух возрастных групп:
- 35–40 лет (пациенты 1–3);
- ˃ 40 лет (пациент 4, 69 лет).
Область лица участников была обработана аппликатором Morpheus8 при стандартных параметрах воздействия (глубина пенетрации 2 мм, плотность энергии 22 мДж/электрод). До и после процедуры у пациентов было получено 8 биоптатов из области обработки. При проведении гистологического исследования оценивались следующие параметры:
- толщина слоев кожи;
- количество фибробластов и клеток воспаления (лимфоциты и макрофаги);
- площадь сосудов в сосочковом и наружной части сетчатого слоя;
- плотность расположения в дерме коллагеновых и эластиновых волокон, а также степень фрагментации эластиновых волокон (анализировали методом полуколичественной балльной оценки по 5-балльной шкале, где 0 — нет, 4 — максимальная интенсивность).
В каждом образце было проанализировано по 5 полей зрения и сделано около 50 измерений по каждому параметру.
Результаты
В таблице представлены данные в виде средних значений ± стандартная ошибка среднего или в виде медианных значений и интерквартильного размаха (в случае балльной оценки признака).

Сопоставление морфологических характеристик кожи пациентов до процедуры Morpheus8
В исходном состоянии у пациента 4 (69 лет) отмечался более низкий показатель толщины эпидермиса (меньше на 28,2%) по сравнению с пациентами в возрасте 39–40 лет, при этом толщина слоев дермы не менялась (рис. 8–10, 14–16).



Результаты свидетельствовали о достоверном снижении с возрастом среднего количества клеток эпидермиса на 38,4%, фибробластов — на 29,5% и клеток воспаления — на 73,7%. Возрастных изменений площади сосудов отмечено не было.
Наблюдалась тенденция к снижению с возрастом плотности коллагеновых волокон (на 33,3%) и увеличению степени фрагментации эластиновых волокон (на 33,3%).






Сопоставление морфологических характеристик кожи пациентов после процедуры Morpheus8
После процедуры в группе пациентов 1–3 была отмечена тенденция к увеличению количества клеток эпидермиса (на 8,1%) и фибробластов (на 21,1%) и к снижению количества клеток воспаления (на 23,5%). У пациента 4 после лечения наблюдалась только тенденция к снижению количества клеток воспаления (на 42,7%) (рис. 11–13, 17–19).



 У обеих возрастных групп пациентов наблюдалось достоверное увеличение площади сосудов: в группе пациентов 1–3 — в 1,8 раза, а у пациента 4 — в 1,7 раза (рис. 20).
У обеих возрастных групп пациентов наблюдалось достоверное увеличение площади сосудов: в группе пациентов 1–3 — в 1,8 раза, а у пациента 4 — в 1,7 раза (рис. 20).
В группе пациентов 1–3 после процедуры было зафиксировано увеличение плотности коллагеновых (на 25%) и эластиновых (на 33,3%) волокон и снижение степени фрагментации эластиновых волокон (в 2 раза). У пациента 4 после лечения наблюдалась тенденция к увеличению плотности эластиновых волокон (в 2 раза) и снижение степени их фрагментации (в 3 раза).
Выводы
В исходном состоянии для кожи пациентов возрастной группы 35–40 лет были характерны умеренные дистрофические изменения в клетках эпидермиса. В сосочковом слое дермы коллагеновые волокна были в основном тонкие и рыхло расположенные, эластиновые волокна также тонкие, редкие и фрагментированные. Иногда в сосочковом слое встречались отдельные участки заметного разрыхления волокон с увеличенным содержанием там лимфоцитов и макрофагов, а также очаги уплотнения и гомогенизации ткани (фиброз, гиалиноз). В сетчатом слое дермы коллагеновые волокна формировали пучки и располагались более плотно, эластиновые волокна были также толще, часто фрагментированные и распределенные неравномерно. Клеточный состав дермы в основном был представлен фибробластами и немногочисленными сосудами с умеренной периваскулярной инфильтрацией из лимфоцитов и макрофагов.
После проведения радиочастотной микроигольчатой терапии Morpheus8 дистрофические изменения клеток эпидермиса практически не выявлялись, в дерме отсутствовали участки резкого разрыхления волокон, а также очаги фиброза и гиалиноза. В сосочковом слое дермы повысилась плотность коллагеновых волокон, эластиновые волокна располагались более равномерно, их степень фрагментации уменьшалась. В сетчатом слое отмечалось увеличение содержания коллагеновых и эластиновых волокон с одновременным уменьшением их фрагментации. В дерме возросло количество фибробластов и сосудов, при этом лимфо-макрофагальная инфильтрация была минимальной.
В биоптате кожи пациента старшего возраста (69 лет) до процедуры отмечалось выраженное истончение эпидермиса. В утолщенном сосочковом слое дермы тонкие коллагеновые волокна были очень плотно расположены, тогда как эластиновых волокон было значительно меньше (гипоэластоз) и наблюдалась их фрагментация. В сетчатом слое отмечалось рыхлое расположение пучков коллагеновых волокон. В наружных участках сетчатого слоя выявлялся гиперэластоз, но в более глубоких участках плотность эластиновых волокон уменьшалась, а фрагментация увеличивалась. Содержание фибробластов и сосудов в слоях дермы было снижено, отмечались немногочисленные лимфоциты и макрофаги.
После микроигольчатой радиочастотной терапии в сосочковом слое повысилось содержание сосудов и эластиновых волокон. Наиболее значительные изменения произошли в сетчатом слое с резким преобладанием над разрыхленными коллагеновыми волокнами многочисленных плотно расположенных эластиновых волокон.
Заключение
Таким образом, проведение радиочастотной микроигольчатой терапии Morpheus8 благотворно сказалось на состоянии кожи пациентов разного возраста: наблюдались выраженная индукция неоэластогенеза и неоваскуляризации, ослабление воспалительной реакции, улучшение структуры эпидермиса, снижение выраженности возрастных изменений и усиление регенеративных свойств. В биоптатах кожи после процедуры было отмечено увеличение количества клеток эпидермиса, фибробластов и сосудов, возросла плотность коллагеновых и эластиновых волокон в слоях дермы, дистрофические изменения клеток и воспалительная инфильтрация были минимальны. Следует отметить, что у пациентов более старшего возраста эффективность радиочастотной микроигольчатой терапии была выше в связи с выраженной стимуляцией эластогенеза в сетчатом слое дермы.
Полученные результаты характеризуют радиочастотную микроигольчатую терапию Morpheus8 как эффективный метод коррекции возрастных изменений кожи лица у пациентов разных возрастных групп.
Литература
- Chambers E.S., Vukmanovic-Stejic M. Skin barrier immunity and ageing. Immunology 2020; 160(2): 116–125.
- Fligiel S.E., Varani J., Datta S.C., et al. Collagen degradation in aged/photodamaged skin in vivo and after exposure to matrix metalloproteinase-1 in vitro. J Invest Dermatol 2003; 120(5): 842–848.
- Cao Q., Tartaglia G., Alexander M., et al. Collagen VII maintains proteostasis in dermal fibroblasts by scaffolding TANGO1 cargo. Matrix Biol 2022; 111: 226–244.
- Baumann L., Bernstein E.F., Weiss A.S., et al. Clinical Relevance of Elastin in the Structure and Function of Skin. Aesthet Surg J Open Forum 2021 14; 3(3): ojab019.
- Uitto J., Li Q., Urban Z. The complexity of elastic fibre biogenesis in the skin — a perspective to the clinical heterogeneity of cutis laxa. Exp Dermatol 2013; 22(2): 88–92.
- Le Page A., Khalil A., Vermette P., et al. The role of elastin-derived peptides in human physiology and diseases. Matrix Biol 2019; 84: 81–96.
- Sugitani H., Hirano E., Knutsen R.H., et al. Alternative splicing and tissue-specific elastin misassembly act as biological modifiers of human elastin gene frameshift mutations associated with dominant cutis laxa. J Biol Chem 2012; 287(26): 22055–22067.
- Halabi C.M., Mecham R.P. Elastin purification and solubilization. Methods Cell Biol 2018; 143: 207–222.
- Pierre A., Lemaire F., Meghraoui-Kheddar A., et al. Impact of aging on inflammatory and immune responses during elastin peptide-induced murine emphysema. Am J Physiol Lung Cell Mol Physiol 2019; 316(4): L608–L620.
- Muto J., Kuroda K., Wachi H., et al. Accumulation of elafin in actinic elastosis of sun-damaged skin: elafin binds to elastin and prevents elastolytic degradation. J Invest Dermatol 2007; 127(6): 1358–1366.
- Janig E., Haslbeck M., Aigelsreiter A., et al. Clusterin associates with altered elastic fibers in human photoaged skin and prevents elastin from ultraviolet-induced aggregation in vitro. Am J Pathol 2007; 171(5): 1474–1482.
- Robert L., Molinari J., Ravelojaona V., et al. Age- and passage-dependent upregulation of fibroblast elastase-type endopeptidase activity. Role of advanced glycation endproducts, inhibition by fucose- and rhamnose-rich oligosaccharides. Arch Gerontol Geriatr 2010; 50(3): 327–331.
- Imokawa G., Ishida K. Biological mechanisms underlying the ultraviolet radiation-induced formation of skin wrinkling and sagging I: reduced skin elasticity, highly associated with enhanced dermal elastase activity, triggers wrinkling and sagging. Int J Mol Sci 2015; 16(4): 7753–7775.
- Kawaguchi Y., Tanaka H., Okada T., et al. Effect of reactive oxygen species on the elastin mRNA expression in cultured human dermal fibroblasts. Free Radic Biol Med 1997; 23(1): 162–165.
- Mulholland S. The InMode Book 2021. https://prev.boomerangfx.com/the-inmode-book-3/
- НОВАЯ КОСМЕТОЛОГИЯ. Аппаратная косметология и физиотерапия. Под общ. ред. Е.И. Эрнандес. М.: ИД «Косметика и медицина», 2019.
- Hantash B.M., Ubeid A.A., Chang H., et al. Bipolar fractional radiofrequency treatment induces neoelastogenesis and neocollagenesis. Lasers Surg Med 2009; 41(1): 1–9.
Статья опубликована в журнале "Косметика и медицина Special edition 2022" №4-2022.
На правах рекламы