«БИОМ МОЛОДОСТИ КОЖИ»: ПРИМЕНЕНИЕ ПРОБИОТИКОВ ДЛЯ БОРЬБЫ С ФОТОСТАРЕНИЕМ И ТЕРАПИИ РАЗЛИЧНЫХ ДЕРМАТОЗОВ
07.12.2019
Антонов Александр Сергеевич
Ведущий тренер-эксперт ГК ERSTA бренда ADVANCED NUTRITION PROGRAMME
Три миллиарда микроорганизмов населяют человеческое тело, и они составляют то, что мы называем микробиотой. Самая большая и самая разнообразная ниша их обитания — кишечник, предоставляющий наиболее комфортные для определенной категории микроорганизмов условия. Многие типы микроорганизмов, каждый в определенном количестве, могут жить там, не вызывая ответную воспалительную реакцию со стороны иммунной системы. Позднее многие исследователи связали характерные для современного человека изменения кишечной микробиоты и дисбактериоз с такими распространенными неблагоприятными факторами, как изменение рациона питания в условиях индустриализации, злоупотребление антибиотиками, а также устранение комменсальных паразитов. Согласно исследованиям, ряд аутоиммунных и аллергических заболеваний развивается чаще при наличии у пациентов перечисленных факторов риска. Эксперименты, в которых были задействованы гнотобиоты, — животные, рожденные и выращенные в стерильных условиях и, следовательно, не обладающие микробиотой, — доказали, что микробиота имеет решающее значение для развития, созревания и нормального функционирования иммунной системы [1, 2].
Формирование благоприятной кишечной микробиоты не только способствует кишечному гомеостазу, но также благотворно отражается на удаленных системах органов и тканей, уменьшая частоту определенной патологии. Результаты проведенных исследований свидетельствуют в пользу взаимосвязи между дисбиозом, воспалением и раком. Мыши с обусловленной генетической модификацией склонностью к воспалительным заболеваниям кишечника (ВЗК), могут заболеть язвенном колитом (ЯК) [3] и колоректальным раком [4] при совместном размещении с животными дикого типа путем горизонтальной и вертикальной передачи патогенных микробов. В то же время микробиота участвует в иммунном ответе против некишечных опухолей. Sivan и соавт. обнаружили, что генетически идентичные животные, купленные в разных лабораториях и в силу этого колонизированные разными бактериями, по-разному реагировали на клеточную линию меланомы В6, имплантированную в их кожу. Фактически введение фекальных суспензий с микроорганизмами уравнивало рост опухоли между животными [5]. Эти результаты предполагают связь между кишечным микробиомом и иммунным ответом против опухолей кожи.
Опираясь на уже известные факты, можно предположить, что целостность кишечного микробиома, по-видимому, является одним из ключевых моментов для нормального развития и функционирования иммунной системы, тогда как дисбаланс микробиома предрасполагает к патологии.
Пробиотики и иммунная система кишечника
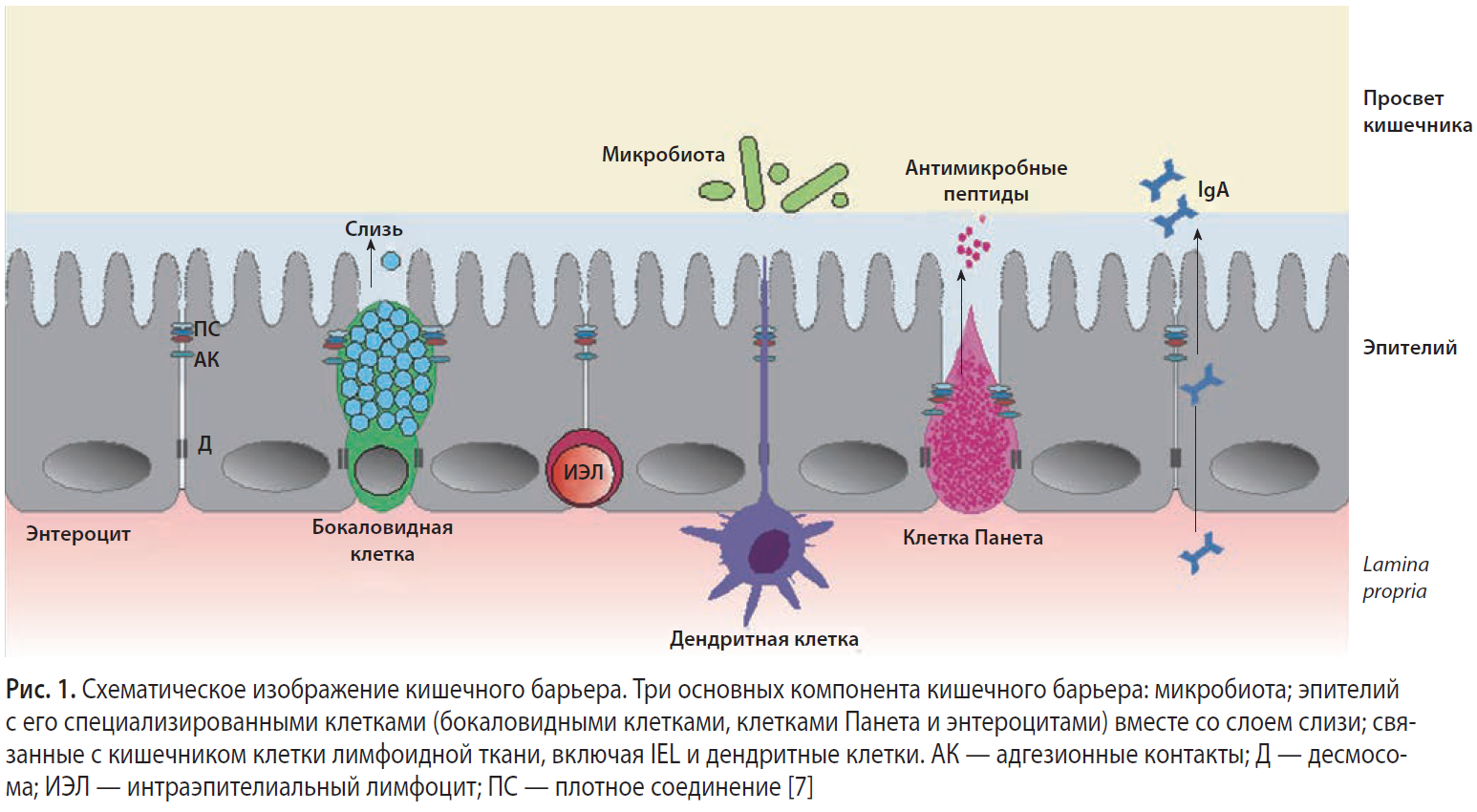
Согласно определению Всемирной организации здравоохранения (ВОЗ), пробиотики представляют собой живые микроорганизмы, которые при введении в адекватных количествах благоприятно сказываются на здоровье. Имеются данные, свидетельствующие о том, что инактивированные или убитые теплом бактерии и полученные из них очищенные молекулы также могут оказывать влияние на лимфоидную ткань, ассоциированную с кишечником (gut-associated lymphoid tissue, GALT) [6].
GALT является наиболее сложным из всех местных отделов иммунной системы. Он состоит из эпителиального барьера, образуемого энтероцитами, интраэпителиальными Т-лимфоцитами, М-клетками и клетками Панета — Давыдова, специализированной соединительной ткани, называемой lamina propria, состоящей из очень разнообразных клеточных линий (таких как макрофаги, дендритные клетки (ДК), плазматические клетки, Т-клетки), известных в качестве эффекторных зон GALT, а также пейеровых бляшек (PP) и брыжеечных лимфатических узлов — индуктивных зон GALT (рис. 1). Индуктивные зоны распознают и представляют антиген, в то время как эффекторные участвуют в синтезе иммуноглобулинов, обеспечивая защиту, толерантность и аллергию.
Согласно проведенному Corthésy обзорному исследованию влияния пробиотиков на GALT, наблюдаемые эффекты обусловлены взаимодействием цельных бактерий, а также полученных из них молекул с образ-распознающими рецепторами энтероцитов, такими как Toll-подобные рецепторы. После распознавания энтероциты секретируют трансформирующий фактор роста ß (ТФР-ß) и ИЛ-8, которые, в свою очередь, модулируют иммунный ответ. Однако пробиотики оказывают иммуномодулирующее действие не только на GALT, но и на другие системы органов и тканей [8].
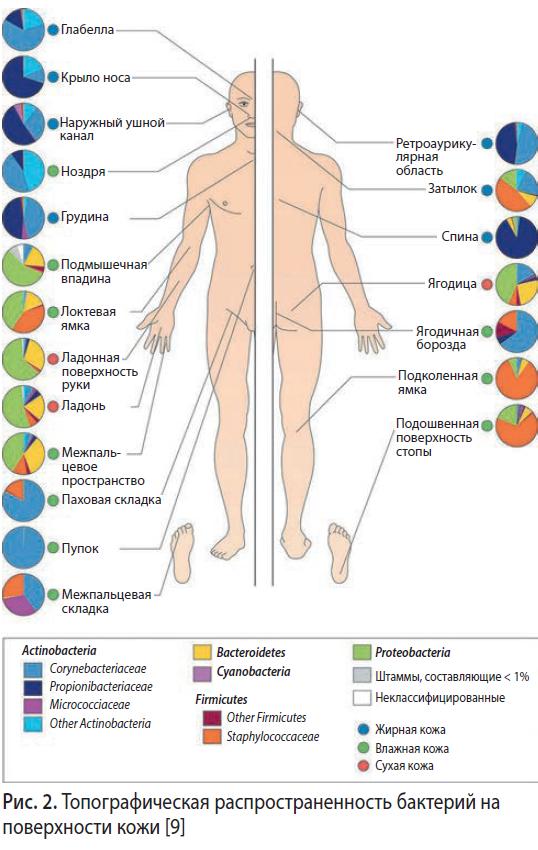
Пробиотики и иммунная система кожи
Кожа является самой большой тканью в организме человека. Подобно кишечнику, она колонизирована миллионами микроорганизмов и обладает своей местной иммунной системой. На один квадратный сантиметр кожи приходится около одного миллиона бактерий (рис. 2). Иммунная система кожи (ИСК) одновременно должна двояко реагировать на контактирующие с ней микроорганизмы: с одной стороны, давать отпор патогенной флоре, с другой — толерантно относиться к своим комменсалам. Зыбкий баланс между микробиотой и ИСК может быть нарушен разнообразными физическими, химическими и биологическими агентами (рис. 3). Возникающий при неблагоприятных условиях дисбактериоз является одним из звеньев патогенеза различных дерматозов (табл. 1).
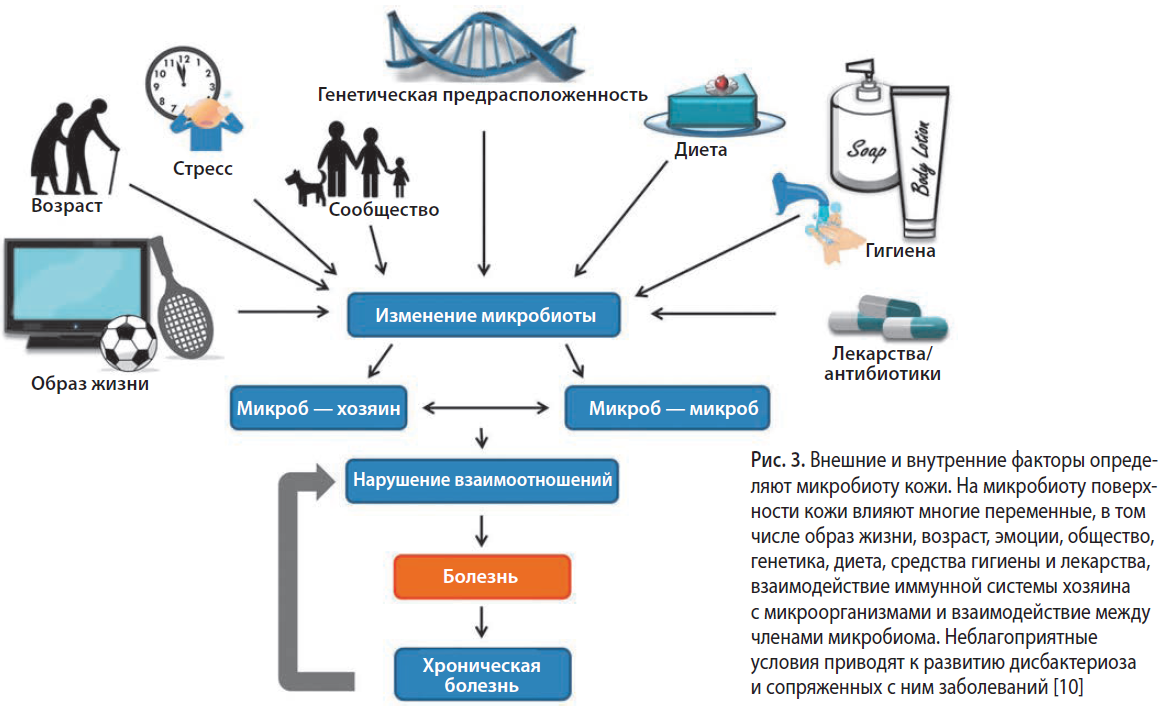
Таблица 1. Кожные заболевания, связанные с дисбактериозом: иммунные нарушения и особенности микробиома. TLR2, 4, 5 — мембранные белки, входящий в группу толл-подобных рецепторов, обеспечивающих функционирование врожденного иммунитета [11]
|
Заболевание |
Иммунные нарушения |
Аномалии кожного микробиома |
Ссылки |
|
Acne vulgaris в стадии воспаления |
↑ защитных белков дефензинов ↑ TLR2 и TLR4 |
↑ P. acnes Повышение доли S. epidermidis |
Jugeau с соавт., 2005 Cunliffe, Gollnick, 2001 Chronnell с соавт., 2001 |
|
Атопический дерматит |
↓ кателицид и дефензины ↑ экспрессии РНКазы 7 и псориазина |
Частые инфекционные дерматиты, колонизация S. aureus |
Ong с соавт., 2002 Miller с соавт., 2005 Hata с соавт., 2010 Mallbris с соавт., 2010 Harder с соавт., 2010 Maintz, Novak, 2011 |
|
Псориаз |
Нарушение естественной экспрессии кателицидина и дефензинов ↑ TLR2 ↓ TLR5 |
Редкая частота штаммов Propionibacterium и Actinobacteria. Преобладание штаммов Firmicutes. Инфекционные осложнения не характерны |
Ong с соавт., 2002 Bensch с соавт., 1995 Miller с соавт., 2005 Harder, Schroder, 2005 |
|
Розацеа |
Нарушение экспрессии кателицидина нарушение экспрессии каликреина 5 ↑ TLR2 |
В патологических очагах патогенные бактерии не обнаружены. Преобладание S. epidermidis; низкая вариабельность микробиома в целом |
Yamasaki с соавт., 2007 Yamasaki с соавт., 2010 Marks, 1968 Whitfeld с соавт., 2011 |
Таким образом, становится ясно, что альтернативные терапевтические стратегии для сохранения нормального микробиома кожи являются потенциально перспективными для лечения различных заболеваний и коррекции патологических изменений кожи.
Первые клинические данные, свидетельствующие о связи между патологией кожи и кишечным микробиомом, появились более десяти лет назад. Избыточный бактериальный рост в тонком кишечнике (small intestine bacterial overgrowth, SIBO) чаще встречается у пациентов с розацеа, чем у здоровых людей. Кроме того, лечение и ликвидация SIBO у пациентов с розацеа устраняют проявления розацеа у 26 из 28 обследованных [12]. С другой стороны, воспалительные заболевания кишечника, такие как язвенный колит и болезнь Крона, часто сопровождаются кожными проявлениями.
Meneghin и соавт. осуществили обзор исследований по применению пробиотиков для профилактики или лечения атопического дерматита (АД) у детей: 13 из 17 исследований засвидетельствовали эффективность в профилактике АД, в то время как 15 из 20 подтвердили клиническую эффективность в лечении этого состояния [13]. Различия, наблюдаемые в каждом клиническом исследовании, могут быть объяснены разнообразием используемых пробиотических организмов (включая различные виды штаммов Lactobacillus и Bifidobacterium и их комбинации), клиническими условиями и критериями оценки. Kukkonen и соавт. провели двойное слепое рандомизированное клиническое исследование, в ходе которого 1223 беременных женщины, вынашивающих детей с высоким риском развития аллергии, принимали в течение 2–4 нед плацебо или капсулы с пробиотиком, включая штаммы L. rhamnosus GG, L. rhamnosus LC705, B. breve Bb99 и Propionibacterium freudenreichii ssp. shermanii JS Новорожденные получали те же капсулы, но с пребиотиками галактоолигосахаридами или плацебо, в течение шести мес. Исследование показало, что не было никаких различий в аллергических состояниях кожи, в то время как частота атопической экземы у двухлетних детей была существенно снижена [14]. Согласно другому исследованию, прием пробиотика L. reuteri снижает частоту возникновения IgE-зависимой экземы у детей [15]. При тестировании B. animalis subsp. lactis LKM512 у взрослых пациентов с АД [16], у убитых воздействием тепла L. acidophilus L-92 [17] и L. salivarius LS01 [18] наблюдался регресс высыпаний.
Возможные механизмы реализации биологических эффектов пробиотиков применимо к коже
Пробиотики или пробиотические молекулы могут модулировать деятельность иммунной системы, активируя ДК, стимулируя NK-клетки, индуцируя различные профили/подтипы дифференцировки Т-клеток, а также через сигнальные пути оси кишечник–мозг–кожа (рис. 4).
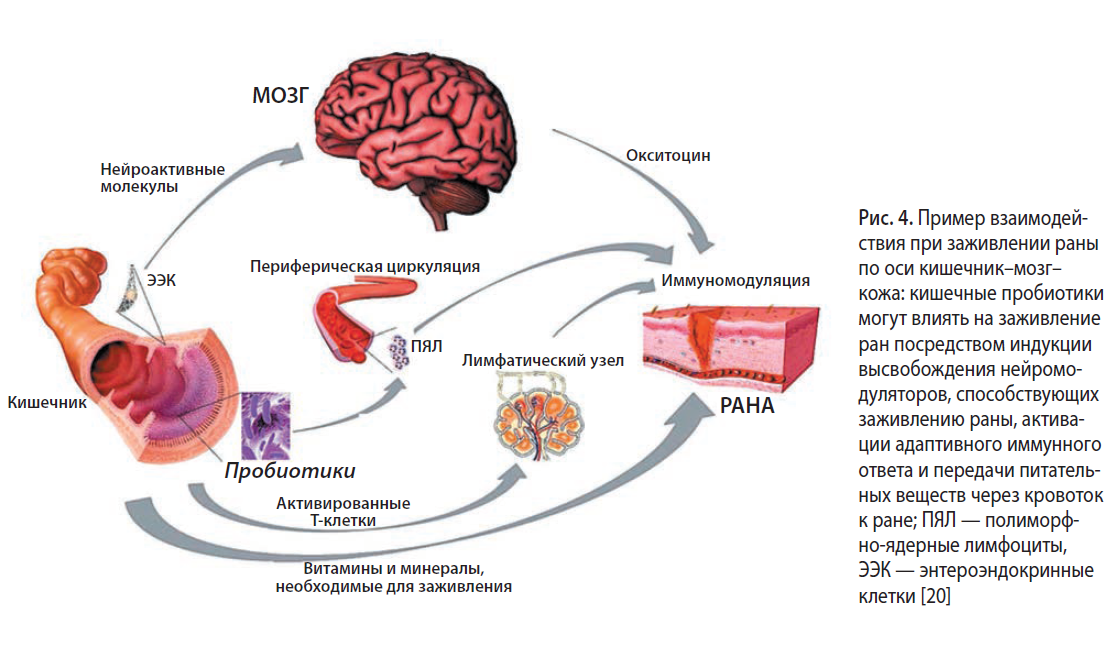
Ученые пытались понять взаимодействие пробиотиков с организмом хозяина на уровне кожи, модулируя реакцию гиперчувствительности немедленного типа (ГЧНТ) или гиперчувствительности замедленного типа (ГЧЗТ). Было показано, что L. casei снижают ГЧНТ, индуцированную как динитрофторбензолом (ДНФБ), так и овоальбумином ГЧЗТ у здоровых животных. Описанный механизм связан со снижением хемотаксиса цитотоксических Т-клеток к пораженной коже, увеличением дифференцировки регуляторных Т-клеток (Tregs) и усилением рекрутирования этих регуляторных клеток на пораженную кожу. Кроме того, Tregs, выделенные из селезенки и лимфатических узлов животных, получавших пробиотик и сенсибилизированных ДНФБ, показали трехкратное увеличение секреции ИЛ-10 после поликлональной стимуляции in vitro. В эксперименте было показано, что у реципиентов, которым были трансплантированы CD8+ T-клетки, выделенные от животных, получавших пробиотик, реакция ГЧНТ протекает менее активно по сравнению с группой, получавшей плацебо. Напротив, при трансплантации Tregs, выделенных от животных, получавших пробиотик, у реципиентов не было зафиксировано отличий реакции ГЧНТ по сравнению с плацебо-группой [19].
В целом эти результаты демонстрируют, что пробиотики способны индуцировать изменение функции CD8+ T-клеток с сохранением эффекторной функции Tregs [20]. В модели мышей с АД, где патология уже была установлена, коктейль для перорального введения, содержащий L. casei, L. plantarum, L. rhamnosus и B. lactis, вызывал снижение уровня IgE, ИЛ-4 и ИЛ-5 с одновременным повышением уровня ИЛ-12p40 и ИФ-ɣ. У получавших пробиотик мышей также наблюдалось снижение инфильтрации и дегрануляции мастоцитов [21]. Это служит доказательством способности пробиотиков не только модулировать активацию подмножеств Т-клеток во время нормальных иммунных реакций, но и воздействовать на растворимые медиаторы при установленных патологических состояниях.
В последние несколько лет системный прием пробиотических средств был предложен в качестве нового метода фотозащиты, который может быть полезен для уменьшения фотостарения, иммуносупрессии, вызванной ультрафиолетом, и профилактикой развития рака. Pequet-Navarro и соавт. провели клиническое исследование, в ходе которого 54 здоровых участника получали L. johnsonii или плацебо в течение 6 нед до облучения ультрафиолетовым излучением. Согласно полученным результатам, для клеток Лангерганса (КЛ) людей, получавших пробиотики, было характерно функциональное восстановление через 4 дня после облучения с более высоким количественным показателем по сравнению с группой плацебо [22].
В другом исследовании L. johnsonii смешивали с каротиноидами и затем вводили здоровым людям до того, как они подверглись облучению ультрафиолетом с высоким уровнем УФ-А. В результате в группе лечения пробиотиком наблюдалось снижение уровня воспалительных дермальных клеток (CD45+), сохранение уровня клеток Лангерганса, увеличение количества дермальных дендроцитов (XIIIa+ клетки) по сравнению с группой плацебо [23]. Однако невозможно определить, был ли наблюдаемый эффект вызван пробиотиками, каротиноидами или их сочетанием. Тот же самый пробиотический штамм, L. johnsonii, был использован Guéniche и соавт. для введения экспериментальным животным в рамках изучения иммуносупрессии, индуцированной ультрафиолетом. Они продемонстрировали, что лечение пробиотиком до облучения приводит к восстановлению клеточного иммунного ответа.
Менее изученным является воздействие ультрафиолетовых лучей на микробиоту кожи. Каждый микроорганизм в коже обладает особой восприимчивостью к ультрафиолету, которая зависит также от времени и интенсивности излучения [24].
В отношении механизмов, которые могли бы объяснить снижение вызванного ультрафиолетовым излучением повреждения кожи при пероральном приеме пробиотиков, как уже упоминалось выше, было показано, что прием содержащего L. johnsonii пробиотика может восстановить популяцию КЛ после облучения УФ-излучением [22] и нивелировать индуцированную им иммуносупрессию у мышей [25].
Оба эффекта могут быть объяснены, по крайней мере частично, снижением уровня ИЛ-10 в крови после УФ-облучения у животных, получавших пробиотики. Согласно другому исследованию, введение L. plantarum может снизить экспрессию и активность ММР-13 у безволосых мышей, тем самым уменьшая фотостарение, вызванное УФ-излучением [26].
Что касается роли ДК в пероральном пробиотическом воздействии на кожу, Sivan и соавт. продемонстрировали, что у животных с имплантированной меланомой, которым вводили коктейль с Bifidobacterium, было больше активированных ДК, проникающих в микроокружение опухоли, чем у животных, получавших физиологический раствор.
Кроме того, эти ДК были способны активировать цитотоксические Т-клетки более эффективно и вызывали более высокие уровни ИФ-ɣ in vitro. Авторы пришли к выводу, что сигналы, производимые Bifidobacterium, но не сами бактерии могут вызывать активацию ДК в стационарном состоянии. В свою очередь, это может привести к улучшению специфической цитотоксической функции Т-клеток и противоопухолевой защиты. Точно так же авторы обнаружили, что очищенная липотейхоевая кислота, полученная из L. rhamnosus GG, вводимая хронически облученным ультрафиолетом животным, увеличивает CD4+ и CD8+ T-клетки, а также секрецию ИФ-ɣ в лимфатических узлах, что существенно снижает риск развития меланомы [27].
Клиническое применение пробиотиков
Было широко известно, что пробиотики облегчают непереносимость лактозы, подавляют диарею, уменьшают симптомы раздраженного кишечника, предотвращают воспалительные заболевания кишечника и проявляют антиколоректальную активность при раке. В последнее время клинические исследования показали, что пробиотики могут оказывать и другие полезные для здоровья эффекты, помимо благополучия кишечника. Было доказано, что пробиотики снижают уровень холестерина в крови (Ooi,и Liong, 2010), оказывают антигипертензивное действие (Yeo и Liong, 2010), способствуют выздоровлению при урогенитальных инфекциях (Abad и Safdar, 2009), уменьшают аллергические реакции (Michail, 2009), предотвращают кариес (Saha et al., 2012), снижают риск возникновения рака (Kumar et al., 2010), облегчают симптомы постменопаузального синдрома (de Vrese, 2009) и проявляют иммуномодулирующие эффекты (Ruemmele et al., 2009). Пробиотики также благотворно сказываются на состоянии кожи, способствуя положительной динамике при атопической экземе, атопическом дерматите, заживлении ожогов и рубцов, оказывают омолаживающее действие на кожу, а также улучшают врожденный иммунитет кожи. Микроорганизмы, относящиеся к группе пробиотиков, приведены в табл. 2 [28].
Таблица 2. Микроорганизмы с пробиотическими свойствами [28]
|
Lactobacillus |
Bifidobacterium |
Enterococcus |
Streptococcus |
|
Lact. acidophilus Lact. brevis Lact. casei Lact. curvatus Lact. fermentum Lact. gasseri Lact. johnsonii Lact. reuteri Lact. rhamnosus Lact. salivarius |
Bif. adolescentis Bif. animalis Bif. breve Bif. infantis Bif. longum Bif. thermophilum
|
Ent. faecalis Ent. faecium |
Strep. thermophilus |
|
Lactococcus |
Propionibacterium |
Дрожжевые штаммы |
Другие |
|
L. lactis subsp. cremoris L. lactis subsp. lactis |
P. freudenreichii P. freudenreichii subsp. shermanii P. jensenii |
Kluyveromyces lactis Saccharomyces boulardii Saccharomyces cerevisiae |
Leuconostoc mesenteroides Pediococcus acidilactici |
Skin Youth Biome: живые культуры пробиотиков для здоровья кожи
Компания Advanced Nutrition Programme™ (Великобритания) разработала комплекс пробиотиков для улучшения здоровья кожи Skin Youth Biome™. Его формула включает 5 млрд бактерий активных культур четырех штаммов с научно доказанной клинической эффективностью: Lactobacillus rhamnosus GG, LGG®, Bifidobacterium longum HA-524®, Pediococcus acidilactici, ROSELL®-175, Lactobacillus reuteri HA-188® (рис. 5–8) (табл. 3).
Таблица 3. Обзор исследований пробиотических свойств Lactobacillus rhamnosus, Bifidobacterium longum, Pediococcus acidilactici, Lactobacillus reuteri [33–37]
|
Дизайн исследования |
Результаты |
|
Lactobacillus rhamnosus (LRh) |
|
|
Изучение барьерной функции реконструированного эпидермиса человека Keraskin™ после нанесения лизата L. rhamnosus, в том числе при последующем контакте с лаурилсульфатом натрия [33] |
Применение лизата LRh на Keraskin™ увеличивало экспрессию белков с плотным соединением; клаудин 1 и окклюдин по данным иммунофлуоресцентного анализа и белков, обеспечивающих барьерную функцию, — лорикрина и филаггрина. Кроме того, цитотоксичность раздражителя кожи, лаурилсульфата натрия (ЛСН), была уменьшена благодаря предварительной обработке культуры клеток лизатом LRh. Защитные эффекты лизата LRh на кожный барьер могут быть дополнительно продемонстрированы ослаблением ЛСН-усиленного проникновения красителя. Лизат LRh также ослаблял разрушение десмосом после обработки ЛСН |
|
Рандомизированное, двойное слепое плацебо-контролируемое исследование. 20 взрослых пациентов с акне принимали внутрь жидкую форму препарата 1 р/день на протяжении 12 нед, содержащую LRh в дозе 3 × 109 КОЕ/день [34] |
Снижение экспрессии инсулиноподобного фактора роста на 32%, усиление экспрессии гена FOXO1 на 65%, сопровождаемое клиническими улучшениями кожных проявлений акне |
|
Bifidobacterium longum (BL) |
|
|
Исследование изменения барьерной функции на клеточной культуре кератиноцитов человека под воздействием лизатов различных пробиотических штаммов in vitro [35] |
Применение лизата BL сопровождалось наиболее выраженным усилением барьерной функции эпидермальных кератиноцитов и усилением синтеза белков, ответственных за барьерную функцию эпидермиса |
|
Pediococcus acidilactici (PA) |
|
|
Обзорное исследование свойств педиоцина, продуцируемого штаммами Pediococcus [36] |
Педиоцин, продуцируемый PA, обладает выраженными антимикробными свойствами |
|
Lactobacillus reuteri (LRe) |
|
|
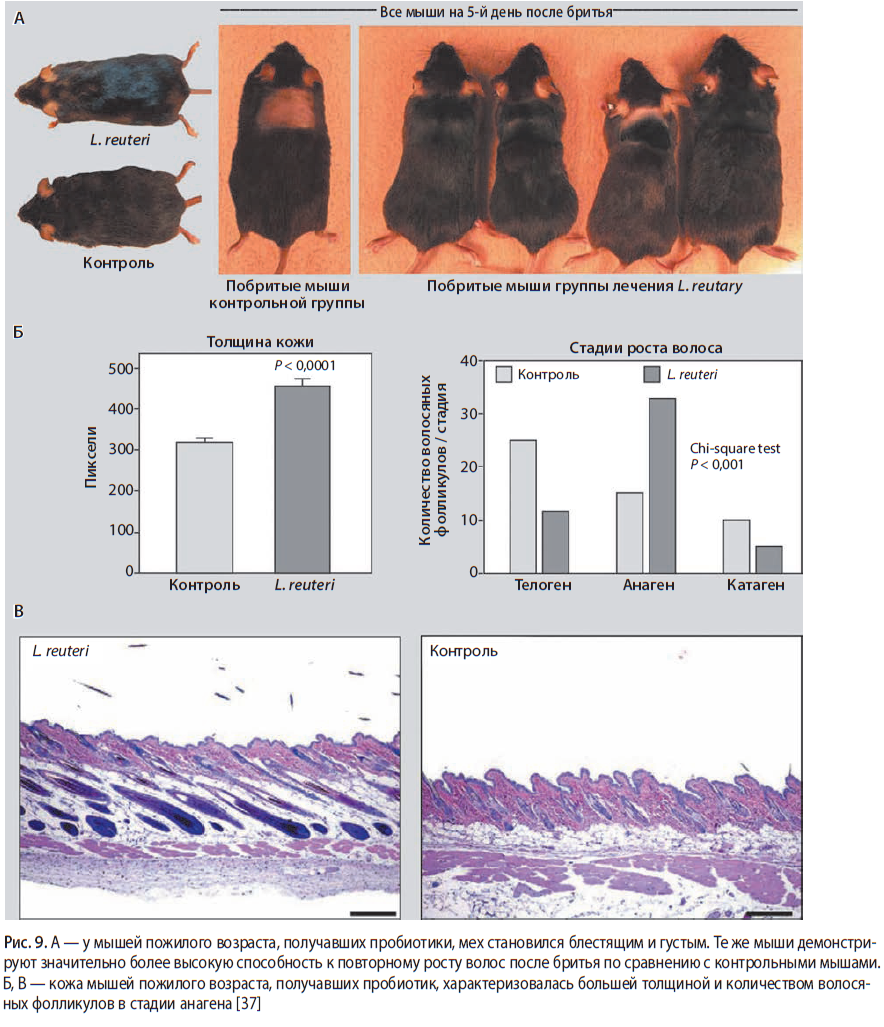
Мышам пожилого возраста перорально вводился содержащий LRe йогурт, шерсть животных была частично сбрита. Авторы оценивали характер восстановления волосяного покрова и характеристики кожи группы мышей, получавших пробиотик, по сравнению с контрольной группой мышей [37] |
Для мышей, получавших пробиотик, было характерно повышение толщины кожи, плотности и качественных характеристик шерсти, скорейшее восстановление волосяного покрова на сбритых участках (рис. 9) |
Комплекс Skin Youth Biome™ объединяет полезные свойства данных штаммов:
- снижение риска развития инфекций благодаря укреплению иммунитета;
- расширенная антиоксидантный защита;
- усиление барьерной функции кожи;
- улучшение реэпителизации кератиноцитов;
- ускорение заживления ран;
- воздействие на биомаркеры оксидативного стресса (который ведет к преждевременному старению).
Кроме того, Skin Youth Biome™ обогащен витамином С, который поддерживает выработку коллагена в коже и участвует в нормализации иммунных функций организма. Такая комбинация живых культур и витамина С не только защищает и поддерживает здоровую микрофлору, но дополнительно усиливает восстановление кожи после фотоповреждения и является средством профилактики преждевременного старения.
Согласно проведенным исследованиям, у 13 пациентов в возрасте 30–60 лет, принимавших данный комплекс на протяжении 12 нед, наблюдалось повышение уровня увлажненности кожи на 43%, уменьшение глубины морщин на 26%, повышение способности кожи удерживать влагу на 25%, а также улучшение гладкости кожи на 5% и эластичности на 3%.
Формула Skin Youth Biome™ создана с использованием технологии микроинкапсуляции, обеспечивающей сохранность бактерий при прохождении через агрессивную среду желудочного сока и их дальнейшее благополучное попадание в кишечник. Капсулы Skin Youth Biome™ упакованы в алюминиевые блистеры, чтобы обеспечить дополнительную защиту от влажности и света. Каждая капсула помещена в отдельную ячейку, обработанную азотом во избежание окисления. Такая упаковка обеспечивает стабильность, целостность и высокое качество продукта в каждой капсуле до окончания срока годности. Продукт прошел множество тестов на стабильность, результаты которых гарантируют сохранность 5 миллиардов активных культур до конца срока годности (2 года при соблюдении условий хранения).
Выводы
Согласно результатам международных клинических исследований, пробиотические микроорганизмы оказывают иммуномодулирующее действие, благодаря чему, с одной стороны, пробиотики способствуют благополучному разрешению воспалительных дерматозов, заживлению ран, улучшению функциональных показателей кожи и усилению ее барьерной функции, а с другой — препятствуют онкологическим заболеваниям и противостоят патогенным микроорганизмам. Комплексный препарат Skin Youth Biome™ включает пробиотические штаммы, характеризующиеся доказанной клинической эффективностью в борьбе с фотостарением и способностью сохранять здоровье кожи.
Статья опубликована в журнале "Косметика и медицина" №4/2019
На правах рекламы
Литература
- Friedrich A.D., Paz M.L., Leoni J., González Maglio D.H. Message in a Bottle: Dialog between Intestine and Skin Modulated by Probiotics. Int J Mol Sci 2017; 18(6): 1067.
- Cebra, J.J. Influences of microbiota on intestinal immune system development. Am J Clin Nutr 1999; 69; 1046S–1051S.
- Garrett W.S., Lord G.M., Punit, S., Lugo-Villarino G., Mazmanian S.K., Ito S., Glickman J.N., Glimcher L.H. Communicable ulcerative colitis induced by T-bet deficiency in the innate immune system. Cell 2007; 131; 33–45.
- Hu B., Elinav E., Huber S., Strowig T., Hao L., Hafemann A., Jin C., Wunderlich C., Wunderlich T., Eisenbarth S.C. Microbiota-induced activation of epithelial IL-6 signaling links inflammasome-driven inflammation with transmissible cancer. Proc Natl Acad Sci USA 2013; 110; 9862–9867.
- Sivan A., Corrales L., Hubert N., Williams J.B., Aquino-Michaels K., Earley Z.M., Benyamin F.W., Lei Y.M.; Jabri B., Alegre M.L.. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science 2015; 350; 1084–1089.
- Cela E.M., Weill F.S., Paz M.L., Leoni J., Maglio D.H.G. Lipoteichoic acid challenge induces higher inflammatory responses than lipopolysaccharide in UV-irradiated keratinocytes. Photodermatol Photoimmunol Photomed 2015; 31; 111–114.
- Abbasiliasi S., Tan J.S., Bashokouh F. In vitro assessment of Pediococcus acidilactici Kp10 for its potential use in the food industry. BMC Microbiol 2017; 17(1): 121.
- Corthésy B., Gaskins H.R., Mercenier A. Cross-talk between probiotic bacteria and the host immune system. J Nutr 2007; 137; 781S–790S.
- Dréno B., Araviiskaia E., Berardesca E. Microbiome in healthy skin, update for dermatologists. J Eur Acad Dermatol Venereol 2016; 30(12): 2038–2047.
- Schommer N.N., Gallo R.L. Structure and function of the human skin microbiome. Trends Microbiol 2013; 21(12): 660–668.
- Gallo R.L., Nakatsuji T. Microbial symbiosis with the innate immune defense system of the skin. J Invest Dermatol 2011;131(10): 1974–1980.
- Parodi A., Paolino S., Greco A., Drago F., Mansi C., Rebora A., Parodi A., Savarino V. Small intestinal bacterial overgrowth in Rosacea: Clinical effectiveness of its eradication. Clin Gastroenterol Hepatol 2008; 6; 759–764.
- Meneghin F., Fabiano V., Mameli C., Zuccotti G.V. Probiotics and atopic dermatitis in children. Pharmaceuticals 2012; 5; 727–744.
- Kukkonen K., Savilahti E., Haahtela T., Juntunen-Backman K., Korpela R., Poussa T., Tuure T., Kuitunen M. Probiotics and prebiotic galacto-oligosaccharides in the prevention of allergic diseases: A randomized, double-blind, placebo-controlled trial. J Allergy Clin Immunol 2007; 119; 192–198.
- Abrahamsson T.R., Jakobsson T., Böttcher M.F, Fredrikson M., Jenmalm M.C., Björkstén B., Oldaeus G. Probiotics in prevention of IgE-associated eczema: A double-blind, randomized, placebo-controlled trial. J. Allergy Clin Immunol 2007; 119; 1174–1180.
- Matsumoto M., Ebata T., Hirooka J., Hosoya R., Inoue N., Itami S., Tsuji K., Yaginuma T., Muramatsu K., Nakamura A. Antipruritic effects of the probiotic strain LKM512 in adults with atopic dermatitis. Ann Allergy Asthma Immunol 2014; 113; 209–216.
- Inoue Y., Kambara T., Murata N., Komori-Yamaguchi J., Matsukura S., Takahashi Y., Ikezawa Z., Aihara M. Effects of oral administration of Lactobacillus acidophilus L-92 on the symptoms and serum cytokines of atopic dermatitis in Japanese adults: A double-blind, randomized, clinical trial. Int Arch Allergy Immunol 2015; 165; 247–254.
- Drago L., Iemoli E., Rodighiero V., Nicola L., de Vecchi E., Piconi S. Effects of Lactobacillus salivarius LS01 (DSM 22775) treatment on adult atopic dermatitis: A randomized placebo-controlled study. Int J Immunopathol Pharmacol 2011; 24; 1037–1048.
- Lukic J., Chen V., Strahinic I. Probiotics or pro-healers: the role of beneficial bacteria in tissue repair. Wound Repair Regen 2017; 25(6): 912–922.
- Hacini-Rachinel F., Gheit H., le Luduec J.B., Dif F., Nancey S., Kaiserlian D. Oral probiotic control skin inflammation by acting on both effector and regulatory T cells. PLoS ONE 2009; 4; e4903.
- Kim M.S., Kim J.E., Yoon Y.S., Seo J.G., Chung M.J., Yum D.Y. A probiotic preparation alleviates atopic dermatitis-like skin lesions in murine models. Toxicol Res 2016; 32; 149–158.
- Peguet-Navarro J., Dezutter-Dambuyant C, Buetler T., Leclaire J., Smola H., Blum S., Bastien P., Breton L., Gueniche A. Supplementation with oral probiotic bacteria protects human cutaneous immune homeostasis after UV exposure-double blind, randomized, placebo controlled clinical trial. Eur J Dermatol 2008; 18; 504–511.
- Bouilly-Gauthier D., Jeannes C., Maubert Y., Duteil L., Queille-Roussel C., Piccardi N., Montastier C., Manissier P., Piérard G., Ortonne J.P. Clinical evidence of benefits of a dietary supplement containing probiotic and carotenoids on ultraviolet-induced skin damage. Br J Dermatol 2010; 163; 536–543.
- Patra V., Byrne S.N., Wolf P. The skin microbiome: Is it affected by UV-induced immune suppression? Front Microbiol 2016, 7, 1235.
- Guéniche A., Oréal L., Buetler T.M. Supplementation with oral probiotic bacteria maintains cutaneous immune homeostasis after UV exposure. Eur J Dermatol 2006, 6, 511–517.
- Kim M., Lee D.E., Park S.D., Kim Y.T., Kim Y.J., Jeong J.W., Jang S.S., Ahn Y.T., Sim J.H., Huh C.S. Oral administration of Lactobacillus plantarum HY7714 protects hairless mouse against ultraviolet B-induced photoaging. J Microbiol Biotechnol 2014, 24, 1583–1591.
- Weill F.S., Cela E.M., Paz M.L., Ferrari A., Leoni J., Maglio D.H.G. Lipoteichoic acid from Lactobacillus rhamnosus GG as an oral photoprotective agent against UV-induced carcinogenesis. Br J Nutr 2013; 109; 457–466.
- Lew L.C., Liong M.T. Bioactives from probiotics for dermal health: functions and benefits. J Appl Microbiol 2013; 114(5): 1241-53.
- Douillard F.P., Rasinkangas P., Bhattacharjee A., Palva A., de Vos W.M. The N-Terminal GYPSY Motif Is Required for Pilin-Specific Sortase SrtC1 Functionality in Lactobacillus rhamnosus Strain GG. PLoS One 2016; 11(4): e0153373.
- Balgir P.P., Kaur B., Kaur T., Daroch N., Kaur G. In vitro and in vivo survival and colonic adhesion of Pediococcus acidilactici MTCC5101 in human gut. Biomed Res Int 2013; 2013: 583850.
- Schiavi E., Gleinser M., Molloy E. The Surface-Associated Exopolysaccharide of Bifidobacterium longum 35624 Plays an Essential Role in Dampening Host Proinflammatory Responses and Repressing Local TH17 Responses. Appl Environ Microbiol 2016; 82(24): 7185–7196.
- Grande R., Celia C., Mincione G. Detection and Physicochemical Characterization of Membrane Vesicles (MVs) of Lactobacillus reuteri DSM 17938. Front Microbiol 2017; 8: 1040.
- Jung Y.O., Jeong H., Cho Y. Lysates of a Probiotic, Lactobacillus rhamnosus, Can Improve Skin Barrier Function in a Reconstructed Human Epidermis Model. Int J Mol Sci 2019; 20(17): 4289.
- Fabbrocini G., Bertona M., Picazo O., Pareja-Galeano H., Emanuele E. Supplementation with Lactobacillus rhamnosus SP1 normalises skin expression of genes implicated in insulin signalling and improves adult acne. Benef Microbes 2016; 7; 625–630.
- Sultana R., McBain A.J., O'Neill C.A. Strain-dependent augmentation of tight-junction barrier function in human primary epidermal keratinocytes by Lactobacillus and Bifidobacterium lysates. Appl Environ Microbiol 2013; 79(16): 4887–4894.
- Kumar B., Balgir P., Kaur B., Garg N. Cloning and expression of bacteriocins of Pediococcus spp.: A review. Archives of clinical microbiology 2011; 2(3:4).
- Erdman S.E., Poutahidis T. Probiotic 'glow of health': it's more than skin deep. Benef Microbes 2014; 5(2): 109–119.