НЕЙРОГЕННОЕ ВОСПАЛЕНИЕ КАК ПРИЧИНА РАЗВИТИЯ РОЗАЦЕА И ТЕРАПЕВТИЧЕСКАЯ МИШЕНЬ
13.09.2023
Глазко Ирина Ивановна
К.м.н., доцент кафедры дерматовенерологии и косметологии с курсом клинической и лабораторной диагностики ИППО ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России, зав. отделением эстетической реабилитации ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России
Любого пациента волнует вопрос о причине развития заболевания, однако далеко не всегда врач может дать на него однозначный ответ. Относительно этиологии большинства заболеваний будут верны два общих суждения: наличие генетической предрасположенности и многофакторный характер. И розацеа как раз не является исключением.
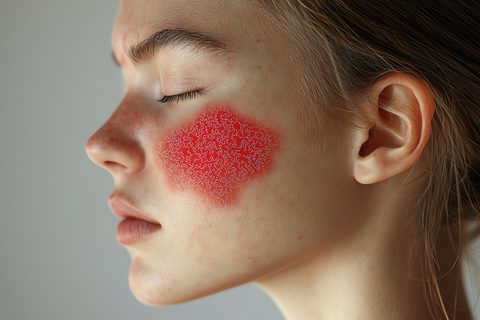
Розацеа — хроническое рецидивирующее воспалительное заболевание кожи с высокой распространенностью во всем мире. Ни этиология, ни генетические предпосылки, ни патофизиологические основы сосудистых, воспалительных и фиброзных изменений кожи, характерных для розацеа, до конца не изучены. Клинические проявления отличаются широкой вариабельностью — от эритемы (расширения сосудов) до папул/пустул (воспалительного инфильтрата) и ринофимы (фиброза, гиперплазии желез).
Последние исследования свидетельствуют о доминирующей роли нейрогенного воспаления, дисрегуляции врожденного и адаптивного иммунитета, а также неблагоприятного качественного и количественного состава микробиома кожи в развитии розацеа [1–3].
Нейрогенное воспаление и хронические воспалительные заболевания кожи
Нейрогенное воспаление представляет собой патологический процесс, в основе которого находятся двунаправленные взаимодействия между клетками нервной и иммунной систем с участием широкого спектра биологически активных веществ [2]. Оно является общим звеном хронических воспалительных заболеваний и патологических состояний кожи, таких как псориаз, атопический дерматит, розацеа, чувствительная кожа и гипертрофические рубцы [4, 5].
Под нейрогенным воспалением понимают высвобождение нейропептидов из нервных клеток в ответ на неинфекционные стимулы, запускающее каскад патогенетически значимых реакций с участием разных типов иммунных клеток и многочисленных физиологически активных веществ [2, 4].
Основная роль нервных окончаний кожи заключается в восприятии и реагировании на внешние факторы окружающей среды для сохранения гомеостаза [5]. В коже присутствуют афферентные волокна, немиелинизированные С-волокна, миелинизированные Аδ-волокна и вегетативные нервные волокна, плотно распределенные по всем ее слоям. Эти волокна выделяют нейропептиды, являющиеся частью кожной нейроэндокринной системы [6]. Роль нейропептидов (нейромодуляторов, нейротрансмиттеров и нейрогормонов) в регуляции лимфоидных, тучных и других клеток иммунной системы заключается в трансформации импульсов от афферентных нервных волокон в сигналы, которые могут считываться иммунокомпетентными клетками, а это чревато усилением воспалительной реакции [7].
Клетки эпидермиса тесно взаимодействуют с нервными окончаниями, активно вырабатывая факторы взаимной коммуникации. Под действием нейропептидов кератиноциты запускают высвобождение в эпидермисе провоспалительных цитокинов, таких как интерлейкин (ИЛ) -1α, ИЛ-6 и ИЛ-8 [6]. Секретируемые из нервных окончаний кожи нейропептиды — субстанция Р (substance P; SP) и кальцитонин-ген-связанный пептид (calcitonin gene-related peptide; CGRP) — соединяются с рецепторами на поверхности тучных клеток и активируют их, приводя к дегрануляции и высвобождению многих провоспалительных цитокинов и вазоактивных аминов (рис. 1).
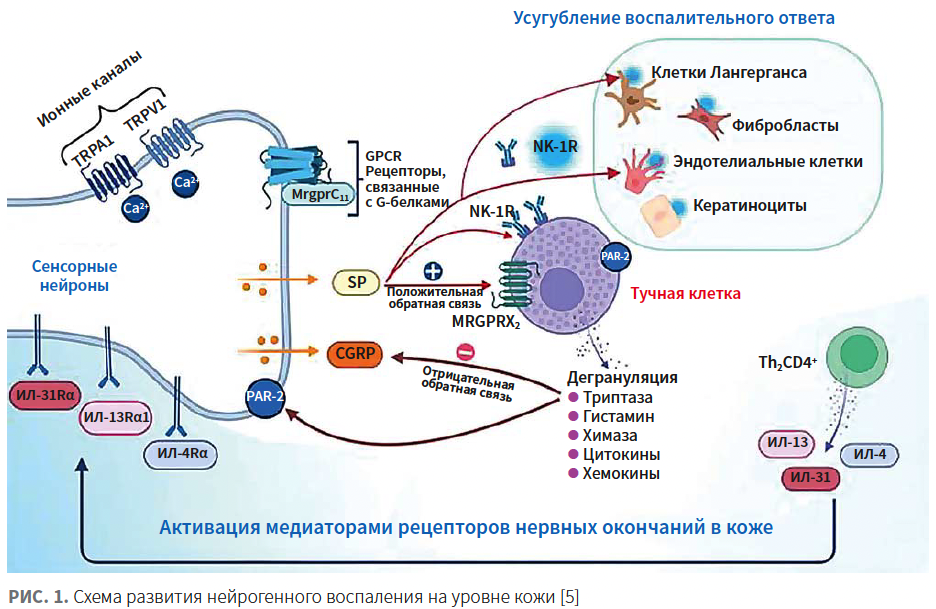
SP, CGRP и вазоактивный интестинальный полипептид (vasoactive intestinal peptide; VIP) являются мощными индукторами высвобождения гистамина из тучных клеток и функционируют через независимую реакцию с IgE на их поверхности. Тахикинины непосредственно вызывают дилатацию и повышение проницаемости капилляров, что приводит к высвобождению гистамина из тучных клеток, отеку и эритеме. Медиаторы, высвобождающиеся при дегрануляции тучных клеток, усиливают воспаление. Значительную роль в возникновении зуда и воспаления играет один из типов рецепторов, связанных с G-белками (Mas-related G-coupled protein receptors; Mrgprs), ионный канал TRPA1 (transient receptor potential ankyrin1) и активируемые протеазами рецепторы 2-го типа (protease-activated receptor 2; PAR-2) [8]. При активации рецептора MrgprX1 происходит дегрануляция тучных клеток. Это, в свою очередь, может привести к развитию нейрогенного воспаления [7].
Нейрогенное воспаление — ключ к разгадке секрета розацеа?
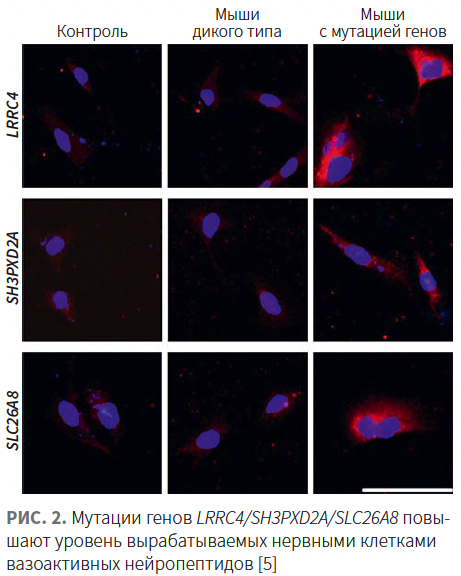
Биологически активные вещества и рецепторы, задействованные в развитии нейрогенного воспаления, находятся под генетическим контролем. Deng Z. и соавт. опубликовали результаты полногеномного секвенирования (whole genome sequencing; WGS), проведенного в 3 больших семьях пациентов с розацеа, и дополнительного полноэкзомного секвенирования (whole exome sequencing; WES) в 49 семьях [3]. В больших семьях выявлены единичные редкие варианты генов LRRC4, SH3PXD2A и SLC26A8. Анализ онтологии генов показывает, что они кодируют белки, участвующие в нейросинаптических процессах и клеточной адгезии. Согласно исследованиям in vitro, мутации в LRRC4, SH3PXD2A и SLC26A8 запускают выработку вазоактивных нейропептидов в нейронах человека (рис. 2). В мышиной модели, повторяющей рецидивирующую мутацию LRRC4, характерную для пациентов с розацеа, авторы наблюдали воспаление кожи, напоминающее розацеа, в основе которого лежит избыточное выделение VIP периферическими нейронами. Полученные результаты подтверждают наличие наследственной предрасположенности и весомый вклад нейрогенного воспаления в развитие розацеа, что существенно углубляет понимание этиопатогенеза розацеа и способствует поиску эффективных терапевтических подходов.
Кожа пациентов с розацеа имеет значительно более низкий порог чувствительности к теплу и химическим веществам по сравнению со здоровой кожей [9]. При эритематозно-телеангиэктатической форме розацеа (ЭТР) наблюдается повышение плотности сенсорных нейронов [10]. Кроме того, при всех подтипах розацеа для сенсорных нейронов, иммунных клеток и кровеносных сосудов характерна повышенная плотность ионных каналов TRP [11]. Для ЭТР также свойственно повышение количества TRPV2 и TRPV3 и экспрессии гена TRPV1. При папуло-пустулезной форме розацеа (ППР) наблюдается повышенная иммунореактивность TRPV2 и TRPV4, а при ринофиме — TRPV3 и TRPV4 [11]. Каждый подтип TRPV имеет свои функции соответственно:
- TRPV1 участвует в регуляции сосудистого тонуса и восприятии боли, активируется капсаицином, теплом и воспалением;
- TRPV2 — во врожденном иммунитете, регуляции сосудистого тонуса и восприятии боли, воспалении и теплоощущении;
- TRPV3 и TRPV4 — в термочувствительности [12].
Помимо TRPV1–4, роль в патогенезе розацеа также была выявлена у TRPA1. TRPA1 активируется такими пряностями, как циннамальдегид и горчичное масло, а также термическими стимулами. В экспериментах на мышах топический циннамальдегид вызывал вазодилатацию по TRPA1-зависимому механизму, что может быть связано с симптомом гиперемии у больных розацеа [13]. TRPA1 также способен реагировать на повышение уровня активных форм кислорода, что может служить подтверждением роли окислительного стресса в развитии розацеа [14]. В нейронах крысы TRPA1 колокализуется с PAR2, который может активироваться протеазами и вызывать воспаление в коже человека. Предположительно, повышенное количество сериновых протеаз при розацеа может индуцировать TRPA1-опосредованное воспаление через регуляцию PAR [15].
В то же время при розацеа наблюдается повышение содержания таких нейропептидов, как пептид-активатор гипофизарной аденилатциклазы (pituitary adenylate cyclase activating polypeptide; PACAP), SP, VIP и CGRP [16]. VIP и PACAP, а также CGRP играют роль мощных вазодилататоров, воздействующих на гладкомышечные клетки артериол, а SP через NK1-рецептор — на гладкомышечные клетки посткапиллярных венул, что играет важную роль в развитии отека. PACAP может стимулировать высвобождение NO из эндотелиальных клеток, что приводит к непрямой вазодилатации [17]. Нейропептиды также активируют тучные клетки, которые выделяют гистамин, вызывающий вазодилатацию, и триптазу, являющуюся хемотаксическим агентом для фибробластов и матриксных металлопротеиназ (matrix metalloproteinases; MMP), способствуя развитию фиброза при розацеа [18]. Кроме того, нейропептиды стимулируют выработку ИЛ-1β и активируют миграцию лейкоцитов за счет повышения уровня молекул адгезии сосудистого эндотелия (vascular cell adhesion molecule; VCAM) при розацеа [19].
Таким образом, при розацеа один из вероятных механизмов развития клинических проявлений заболевания можно представить следующим образом: наличие генетической предрасположенности обусловливает активацию нервных окончаний в ответ на действие свойственных розацеа триггерных факторов:
- солнечного излучения;
- алкоголя;
- острой пищи;
- горячих напитков или пищи;
- жаркого/холодного климата;
- декоративных и уходовых косметических средств;
- психоэмоционального стресса.
Высвобождаемые в ответ на действие триггеров нейромедиаторы стимулируют синтез клетками иммунной системы провоспалительных цитокинов, которые запускают процесс воспаления, проявляющийся в виде характерных симптомов розацеа — эритемы, телеангиэктазий, папул и пустул.
Следует также отметить, что еще одним триггером служат характерные для розацеа качественные и количественные изменения состава микробиома кожи. Обитающие на поверхности кожи микроорганизмы тесно взаимодействуют с иммунной системой кожи. При розацеа наблюдается повышение численности Cutibacterium acnes, Staphylococcus epidermidis, Bacillus oleronius и Demodex folliculorum, что создает провоспалительный фон и способствует ослаблению барьерных функций кожи, повышая восприимчивость к действию внешних деструктивных факторов [20].
TOLERIANE ROSALIAC AR: успокаивающий уход за кожей, склонной к розацеа
Многофакторная этиология розацеа и сложный патогенез обусловливают необходимость в комплексном воздействии, охватывающем разные звенья патогенеза розацеа.
Примером топического средства, нацеленного на основные патогенетические пути развития заболевания, может служить сыворотка TOLERIANE ROSALIAC AR (Дерматологическая лаборатория La Roche-Posay, Франция), разработанная специально для кожи, склонной к покраснению и куперозу.
Активные компоненты сыворотки преследуют три основные цели:
- нормализацию повышенной чувствительности кожи;
- уменьшение воспаления;
- восстановление эпидермального барьера;
- формирование здорового микробиома кожи (табл. 1).
Таблица 1. Характеристика запатентованных компонентов сыворотки TOLERIANE ROSALIAC AR
|
Компонент |
Свойства |
Результаты исследований |
|
Нейросенсин (Neurosensine®) |
Представляет собой пептидную последовательность (тирозин-аргинин), химически модифицированную (длинноцепочечный липофильный конъюгат) для улучшения проникновения в кожу. Нейросенсин препятствует нейрогенному воспалению посредством следующих механизмов:
|
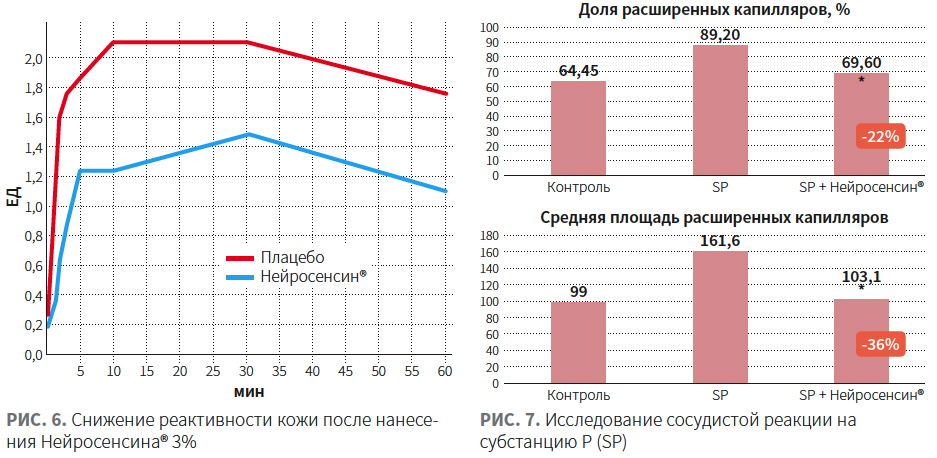
Исследование тактильной чувствительности: 18 участников, стимуляция тактильной чувствительности листами бумаги с разной зернистостью через 1, 2 и 3 ч после нанесения Нейросенсина или плацебо. Наблюдалось значительное снижение тактильной чувствительности после нанесения Нейросенсина (рис. 4). Исследование термической чувствительности: 21 участник, субъективная оценка участниками степени нагрева кожи (4 температуры нагрева) в интактном состоянии и через 2 ч после нанесения плацебо или Нейросенсина 3%. Нейросенсин снизил восприятие нагрева кожи приблизительно на 1 °C (рис. 5). Исследование реактивности кожи: 14 участников, воздействие капсаицином 0,075% на кожу щеки (с одной стороны на кожу щеки предварительно был нанесен Нейросенсин, с другой — плацебо). На стороне нанесения Нейросенсина наблюдалось снижение раздражения на 46%, ощущения пульсации на 50%, ощущения саднения на 45% (рис. 6). Исследование сосудистой реакции invitro на образцах кожи путем нанесения субстанции P: топическое нанесение Нейросенсина позволило достичь снижения числа расширенных капилляров, уменьшения общей площади расширенных сосудов (рис. 7) |
|
Сфингобиома (Sphingobioma®) |
Экстракт более чем 400 видов грамотрицательных бактерий из термальной воды La Roche-Posay:
|
В исследовании in vitro концентраты Sphingomonas 0,4% и 0,5% ингибировали пре-калликреиновую активность на 54% и 91,1% соответственно. Через 4 ч после нанесения на кожу экстракта Сфингобиома степень гидратации кожи повысилась на 56%. |
|
Свитон (Sweetone®) |
Активный ингредиент экстракта из ягод Schisandra sphenanthera. Модулирует неспецифическое и сосудистое воспаление, ограничивая покраснение, и уменьшает нейрогенное воспаление, успокаивая чувствительную кожу |
Свитон 0,1%:
В исследовании с участием 60 женщин (средний возраст 36 лет) с повышенной чувствительностью и покраснением кожи, разделенных на 2 группы, нанесение крема, содержащего Свитон 0,5%, 2 р/день на протяжении 56 дней способствовало значительному уменьшению площади сосудов, снижению риска покраснения кожи на 83%, интенсивности диффузного покраснения на 76%, ограничению локального покраснения на 69% (рис. 8) |
|
Термальная вода La Roche-Posay® |
Смягчающее и противовоспалительное действие, содержит селен (0,053 мг/л) и стронций (0,3 мг/л), необходимые для катализации бактериальных ферментов |
Согласно 20 исследованиям (12 in vivo + 8 in vitro), термальная вода La Roche-Posay обладает антиоксидантными, смягчающими, противовоспалительными, противоотечными, ранозаживляющими, про- и пребиотическими свойствами |


В состав сыворотки TOLERIANE ROSALIAC AR также входят глицерин и масло ши. Масло ши обеспечивает кожу жирными кислотами, способствуя укреплению липидного барьера. Глицерин необходим для повышения гидратации кожи, восстановления эпидермального барьера, нормализации клеточного цикла кератиноцитов и повышения эластичности кожи.
Эффективность сыворотки TOLERIANE ROSALIAC AR была подтверждена результатами лабораторных и клинических исследований (табл. 2).
Таблица 2. Лабораторные и клинические исследования эффективности сыворотки TOLERIANE ROSALIAC AR
|
Выборка |
Протокол |
Результаты |
|
26 женщин в возрасте 18–65 лет с жалобами на сухость кожи передней поверхности предплечий |
Однократное нанесение, измерение степени гидратации кожи при помощи корнеометра через 30 мин, 4, 8 и 48 ч |
Измерение гидратации кожи:
|
|
26 женщин в возрасте 18–65 лет |
Проведение соскоба липкой лентой на поверхности предплечья, оценка трансэпидермальной потери воды (ТЭПВ) до и после соскоба, расчет Естественного восстановления кожи (Natural recovery improvement; NRI) |
Значительно меньший показатель ТЭПВ через 1–6 ч после соскоба при нанесении средства по сравнению с кожей, на которую не наносилось средство (рис. 9). Значимое улучшение NRI во всех временных точках |
|
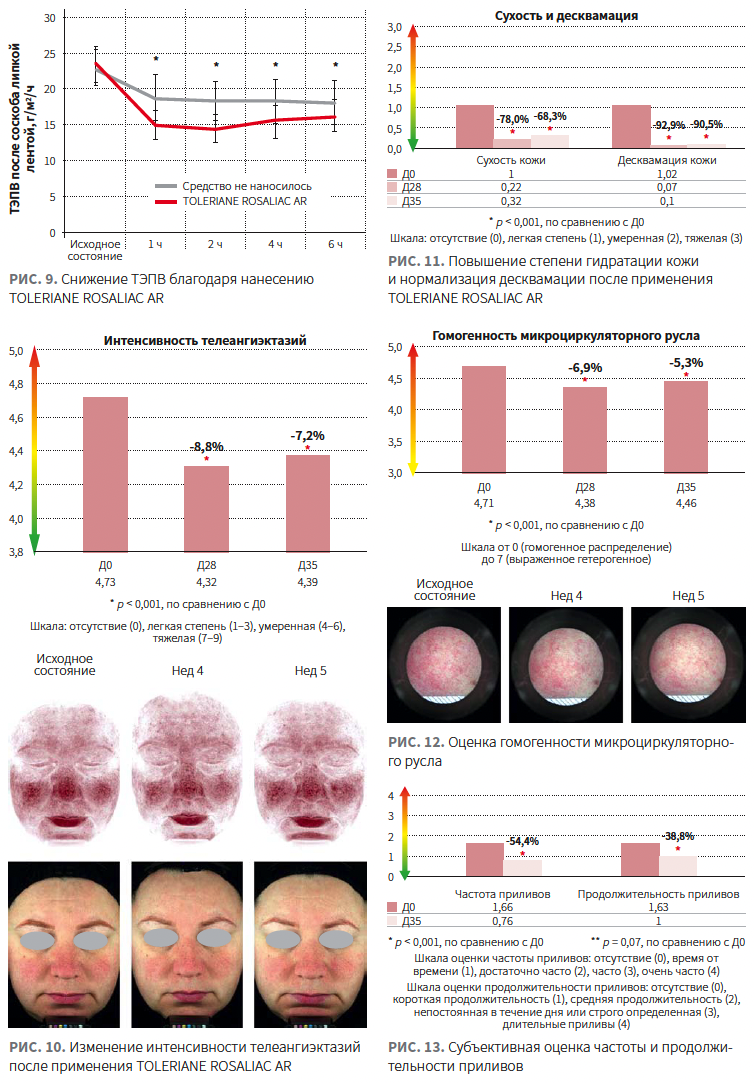
53 женщины в возрасте 23–65 лет со всеми типами кожи лица (жирная/комбинированная/сухая/нормальная) и повышенной чувствительностью, наличие эритемы, телеангиэктазий, чувства стянутости, приливов, сосудистых нарушений |
Сыворотка TOLERIANE ROSALIACAR 2 р/день с Д0 по Д27, Hydreane Légère 2 р/день с Д28 по Д35 |
Уменьшение выраженности телеангиэктазий, повышение степени гидратации кожи и нормализация десквамации, сохраняющиеся еще 1 нед после прекращения топической терапии (рис. 10, 11). Повышение гомогенности микроциркуляторного русла после 4 нед топической терапии. Результаты сохранялись еще 1 нед после прекращения использования средства (рис. 12). Улучшение показателей щипкового теста. Значимое сокращение частоты и длительности приливов к Д35 по сравнению с Д0 (рис. 13) |
Согласно результатам проведенных исследований, активные ингредиенты сыворотки TOLERIANE ROSALIAC AR воздействуют на основные звенья патогенеза розацеа:
- блокируют пути развития нейрогенного воспаления;
- способствуют нормализации повышенной чувствительности кожи;
- восстанавливают и укрепляют эпидермальный барьер;
- повышают степень гидратации кожи;
- улучшают микроциркуляцию;
- способствуют формированию здорового микробиома кожи.
Топическое применение сыворотки приводит к регрессу симптомов розацеа и улучшению качества жизни пациентов. Достигнутые улучшения сохраняются определенный период после прекращения топической терапии.
Поскольку одним из основных триггеров розацеа выступает солнечное излучение, фотопротекция является важной составляющей комплексной терапии заболевания. В дополнение к сыворотке TOLERIANE ROSALIAC AR рекомендуется применение крема TOLERIANE ROSALIAC AR SPF 30, защищающего кожу от агрессивного действия ультрафиолета A и ультрафиолета B.
Заключение
В отдельных научных публикациях нейрогенное розацеа выделяется в качестве одного из типов заболевания. Тем не менее, согласно рассмотренным исследованиям, компоненты нейрогенного воспаления есть при любой клинике заболевания, что делает патогенетически обоснованным применение топических средств, воздействующих на пути развития нейрогенного воспаления. Примером такого средства может служить сыворотка TOLERIANE ROSALIAC AR. Благодаря запатентованным компонентам топическое применение сыворотки приводит к уменьшению реактивности кожи в ответ на действие триггерных факторов. Сыворотка TOLERIANE ROSALIAC AR может быть рекомендована в качестве уходового средства при наличии склонности к развитию розацеа, а также в составе комплексной терапии заболевания.
Литература
- Holmes A.D., Steinhoff M. Integrative concepts of rosacea pathophysiology, clinical presentation and new therapeutics. ExpDermatol 2017; 26(8): 659–667.
- Кучер А.Н. Нейрогенное воспаление: биохимические маркеры, генетический контроль и болезни. Бюллетень сибирской медицины 2020; 19(2): 171–181.
- Deng Z., Chen M., Zhao Z., et al. Whole genome sequencing identifies genetic variants associated with neurogenic inflammation in rosacea. Nat Commun 2023; 14(1): 3958.
- Rosa A.C., Fantozzi R. The role of histamine in neurogenic inflammation. Br J Pharmacol 2013; 170(1): 38–45.
- Marek-Jozefowicz L., Nedoszytko B., Grochocka M., et al. Molecular Mechanisms of Neurogenic Inflammation of the Skin. Int J Mol Sci 2023; 24(5): 5001.
- Slominski A.T., Slominski R.M., Raman C., et al. Neuroendocrine Signaling in the Skin with a Special Focus on the Epidermal Neuropeptides. Am J Physiol Cell Physiol 2022; 323(6): C1757–C1776.
- Choi J.E., di Nardo A. Skin Neurogenic Inflammation. Semin Immunopathol 2018; 40(3): 249–259.
- Steinhoff M., Neisius U., Ikoma A., et al. Proteinase-Activated Receptor-2 Mediates Itch: A Novel Pathway for Pruritus in Human Skin. J Neurosci 2003; 23(15): 6176–6180.
- Guzman-Sanchez D.A., Ishiuji Y., Patel T., et al. Enhanced skin blood flow and sensitivity to noxious heat stimuli in papulopustular rosacea. J Am Acad Dermatol 2007; 57(5): 800–805.
- Schwab V.D., Sulk M., Seeliger S., et al. Neurovascular and neuroimmune aspects in the pathophysiology of rosacea. J Investig Dermatol Symp Proc. 2011; 15(1): 53–62.
- Sulk M., Seeliger S., Aubert J., et al. Distribution and expression of non-neuronal transient receptor potential (TRPV) ion channels in rosacea. J Invest Dermatol 2012; 132(4): 1253–1262.
- Ni Raghallaigh S., Powell F.C. Epidermal hydration levels in patients with rosacea improve after minocycline therapy. Br J Dermatol 2014; 171(2): 259–266.
- Pozsgai G., Bodkin J.V., Graepel R., et al. Evidence for the pathophysiological relevance of TRPA1 receptors in the cardiovascular system in vivo. Cardiovasc Res 2010; 87(4): 760–768.
- Graepel R., Fernandes E.S., Aubdool A.A., et al. 4-oxo-2-nonenal (4-ONE): evidence of transient receptor potential ankyrin 1-dependent and -independent nociceptive and vasoactive responses in vivo. J Pharmacol Exp Ther 2011; 337(1): 117–124.
- Dai Y., Wang S., Tominaga M., et al. Sensitization of TRPA1 by PAR2 contributes to the sensation of inflammatory pain. J Clin Invest 2007; 117(7): 1979–1987.
- Baylie R.L., Brayden J.E. TRPV channels and vascular function. Acta Physiol (Oxf) 2011; 203(1): 99–116.
- Seeliger S., Buddenkotte J., Schmidt-Choudhury A., et al. Pituitary adenylate cyclase activating polypeptide: an important vascular regulator in human skin in vivo. Am J Pathol 2010; 177(5): 2563–2575.
- Muto Y., Wang Z., Vanderberghe M., et al. Mast cells are key mediators of cathelicidin-initiated skin inflammation in rosacea. J Inves Dermatol 2014; 134(11): 2728–2736.
- Shi X., Wang L., Li X., et al. Neuropeptides contribute to peripheral nociceptive sensitization by regulating interleukin-1beta production in keratinocytes. Anesth Analg 2011; 113(1): 175–183.
- Daou H., Paradiso M., Hennessy K., Seminario-Vidal L. Rosacea and the Microbiome: A Systematic Review. Dermatol Ther(Heidelb) 2021; 11(1): 1–12.