KARISMA — ИНЪЕКЦИОННЫЙ КОЛЛАГЕНОСТИМУЛЯТОР НА ОСНОВЕ РЕКОМБИНАНТНОГО КОЛЛАГЕНА I ТИПА ДЛЯ ОМОЛОЖЕНИЯ КОЖИ
20.12.2023
Erid: 2Ranymop4sA
Роберти Анна Робертовна
врач-дерматовенеролог, косметолог, научный руководитель медицинской компании JES
Биофизические свойства кожи определяются взаимодействиями между клетками, цитокинами и факторами роста, ареной для которых служит внеклеточный матрикс (ВКМ) [1].
Большинство белков ВКМ представляют собой макромолекулы, состоящие либо из одной (нидогены, фибриллины, фибулины), либо из нескольких (коллаген, ламин) полипептидных цепей. Важной характеристикой белков ВКМ является то, что они собираются в сложные сети, состав и архитектура которых определяют биофизические свойства тканей, такие как жесткость, растяжимость и упругость (рис. 1) [2].
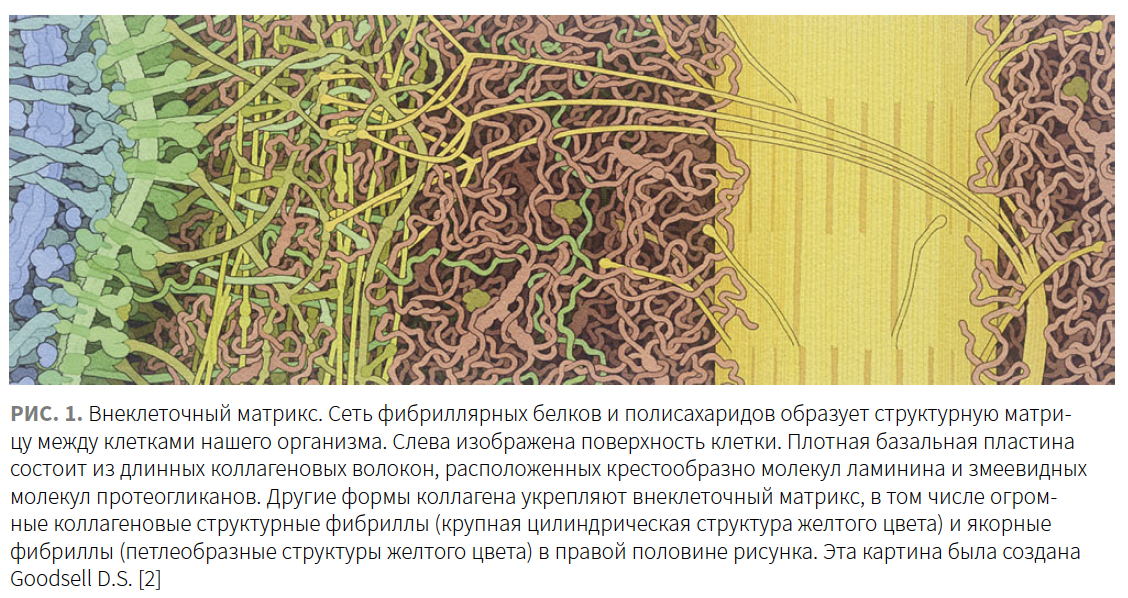
Сборка белков ВКМ в нерастворимые и сложные полимеры — регулируемый процесс, адаптированный к развитию, ремоделированию тканей, репарации, старению и заживлению ран. И наоборот, жесткость и податливость тканей являются важными факторами, определяющими влияние ВКМ на клетки [1]. Эта регуляция осуществляется напрямую посредством взаимодействия белков ВКМ с рецепторами клеточной поверхности и активацией специфических сигнальных путей либо косвенно, поскольку активность и распространение сигнальных молекул, таких как цитокины и факторы роста, контролируются за счет временной изоляции внутри сетей.
Коллаген I, эластин и протеогликаны являются тремя основными группами дермальных белков ВКМ, секретируемыми главным образом дермальными фибробластами под воздействием трансформирующего фактора роста бета (transforming growth factor β; TGF-β) — многофункционального фактора роста, регулирующего экспрессию, отложение и оборот белков ВКМ кожи [3].
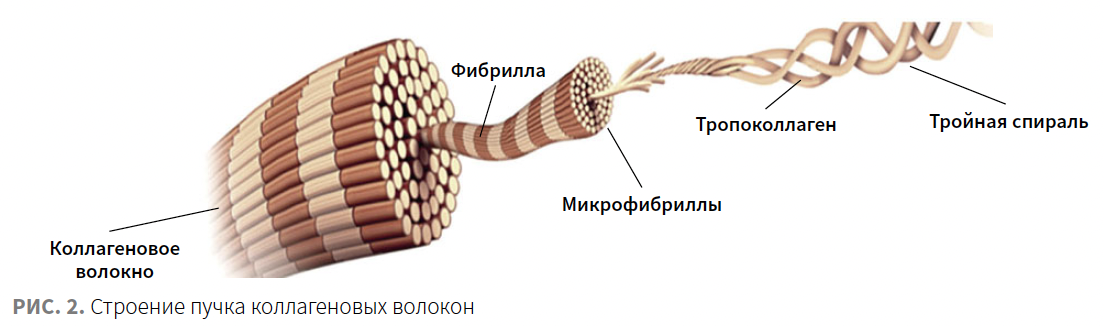
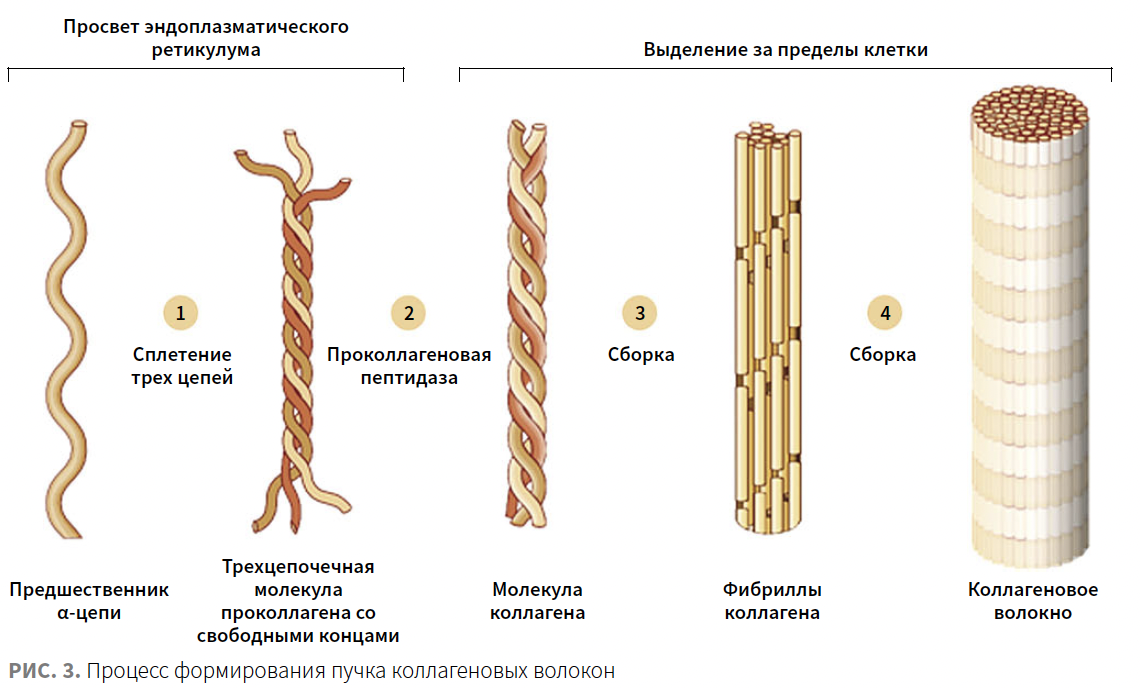
На коллаген приходится 75% сухого веса дермы. Коллаген I типа является наиболее распространенной формой коллагена в тканях человека и состоит из 3 левосторонних α-цепей: двух идентичных α1-цепей I типа и одной α2-цепи I типа, организованных в естественную тройную спиральную структуру (рис. 2). Проколлаген образуется путем намотки α-цепи предшественника в фибробласте (стадия 1). Он выводится за пределы клетки, где подвергается дальнейшим модификациям и превращается в тропоколлаген (стадия 2). Тропоколлаген перестраивается в параллельные ряды, образуя фибриллы (этап 3). Фибриллы трансформируются в волнистые или параллельные пучки и формируют правильные коллагеновые волокна (шаг 4) (рис. 3).
Для стареющей кожи характерны снижение количества функционально активных дермальных фибробластов и накопление стареющих фибробластов. Эти клетки не способны синтезировать коллаген в достаточном количестве, зато активно секретируют провоспалительные цитокины, хемокины и матриксные металлопротеиназы — ферменты, разрушающие компоненты внеклеточного матрикса, такие как коллагеновые фибриллы. Возрастные изменения фибробластов приводят к снижению регенераторного потенциала кожи [4].
С возрастом ВКМ претерпевает существенные гистопатологические и иммуногистохимические изменения, обусловленные естественным процессом старения (хронологическое старение) и действием факторов окружающей среды, главным образом — ультрафиолетового (УФ) излучения (фотостарение) [5].
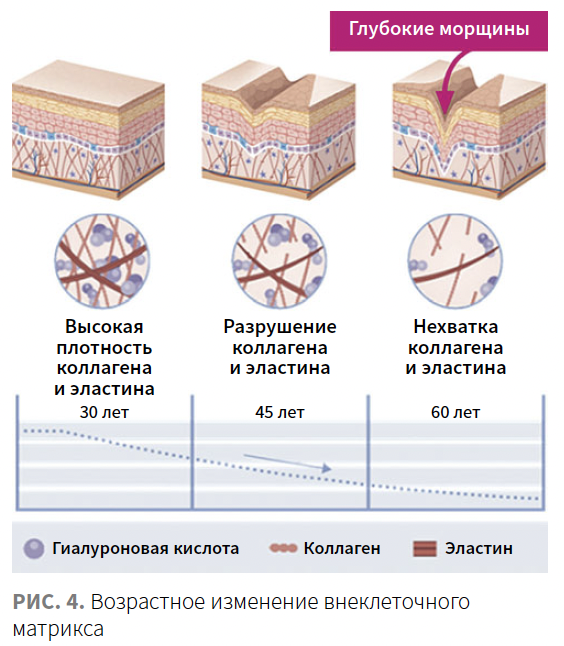
Хронологическое старение характеризуется старением клеток и изменением уровня коллагена, эластина и гликозаминогликанов, включая гиалуроновую кислоту (ГК) [6]. Дефицит уровня коллагена и деградация ВКМ нарушают прикрепление дермальных фибробластов внутри дермы, что приводит к изменению клеточной морфологии и снижению механического напряжения. В свою очередь, достаточное механическое напряжение фибробластов — необходимое условие для синтеза компонентов ВКМ на высоком уровне. Возникает порочный круг. Снижение активности синтеза белков и гликозаминогликанов сопровождается ростом уровня ферментов, разрушающих матрикс. Зрелые интерстициальные коллагеновые фибриллы устойчивы к большинству протеолитических ферментов, но подвержены разрушению коллагенолитическими матриксными металлопротеиназами (matrix metalloproteinase; ММР) 1, 8 и 134 (рис. 4) [7].

Фотостарение усугубляет возрастное снижение уровня коллагена сетчатого слоя дермы, накопление поврежденных, дезорганизованных коллагеновых, эластиновых волокон и гликозаминогликанов (рис. 5) [8]. Также отмечается увеличение экспрессии матриксных металлопротеиназ и коллагеназ, в частности ММР-1, -3, -9, -11 и -12 [6]. Предположительно, УФ-излучение оказывает прямое деструктивное воздействие на целостность эластиновых микрофибрилл и пространственную организацию эластиновых волокон [9]
Одной из основных причин возрастных изменений кожи служит снижение антиоксидантной защиты, приводящее к внутриклеточному повышению уровня активных форм кислорода (АФК). Они образуются в результате аэробного метаболизма и служат сигналом к повышению экспрессии ММР и снижению синтеза коллагена. Образование АФК непосредственно связано с повреждением белков и усилением экспрессии и активности ММР в коже в рамках хроно- и фотостарения [10]. Более того, поврежденные белки ВКМ могут выполнять функцию фотосенсибилизаторов, усиливая генотоксичность УФ-излучения и, следовательно, способствуя фотостарению кожи [11]
Старение кожи тесно связано с окислительным стрессом — явлением, характеризующимся дисбалансом между активными формами кислорода (АФК) и антиоксидантами. Высокие уровни АФК окисляют клеточные белки, ДНК и липиды, вызывая воспаление, окислительное повреждение и старение дермальных фибробластов [4].
С возрастом дисбаланс между синтезом и деградацией белков ВКМ приводит к активации процессов гликирования — связывания сахаров с молекулярными структурами, такими как белки, липиды и нуклеиновые кислоты, в ходе которого образуются конечные продукты гликирования (advanced glycation end product; AGE), участвующие в патогенезе возраст-ассоциированных заболеваний [12].
Гликирование было признано одним из мощных факторов, ускоряющих старение кожи. Выработка AGE сопряжена с образованием АФК и модуляцией сигнального пути MAPK, что влечет за собой запуск транскрипции ядерного фактора каппа-би (NF-κB), активацию MMP и образование различных провоспалительных цитокинов [13]. Гликирование и AGE делают коллаген более жестким и ломким, видоизмененный коллаген не может выполнять полноценно свои функции [14]. Процесс гликирования также приводит к значимым функциональным изменениям дермальных фибробластов — снижается их пролиферативная активность и способность к миграции, а также уровень коллагена в ВКМ [15]. Таким образом, естественные возрастные изменения ВКМ усугубляются действием УФ-излучения, окислительным стрессом и гликированием.
В недавних исследованиях ВКМ рассматривается в качестве общей структуры, которая заполняет пространство между клетками и соединяет организм в единое целое. В настоящее время исследования сосредоточены на составе и сигнальных путях ВКМ [16]. Полученные результаты в этой области способствовали разработке эффективных стратегий профилактики и коррекции возрастных изменений кожи [17].
Применение соединений на основе коллагена для омоложения кожи
В последние десятилетия наблюдается огромный спрос на стратегии реконструкции и ремоделирования мягких тканей [18]. Были проведены интенсивные научные и промышленные исследования для разработки инновационных подходов или оптимизации существующих решений. Коллаген I типа является одним из наиболее широко используемых в медицине биоматериалов [19]. В последние два десятилетия препараты на основе коллагена I типа и его производных (например, гидролизаты, желатин, пептиды) получили широкое распространение благодаря способности восстанавливать структуру и функции мягких тканей путем запуска коллагеногенеза и воссоздания оптимального для клеток внешнего пространства [20]. Именно поэтому данные препараты называют коллагеностимуляторами или биореструктуризантами.
На рынке доступно более 60 видов инъекционных препаратов на основе коллагена. Наиболее распространенными источниками коллагена для их производства являются ткани крупного рогатого скота, свиней, лошадей и человека.
Коллаген в природе представляет собой крупную белковую молекулу, которая при ферментативном гидролизе образует очень маленькие биоактивные пептиды с интересными биологическими функциями. На уровне кожи коллагеновые пептиды действуют как пептиды ложной деградации коллагена, которые посылают ложный сигнал клеткам фибробластов синтезировать новые коллагеновые волокна, а также снижают образование гликированного коллагена [21]. Более того, коллагеновые пептиды обладают хемотаксическими свойствами — они могут способствовать миграции и пролиферации клеток, что является важным процессом при заживлении ран [22]. Способность пептидов коллагена стимулировать пролиферацию фибробластов, активировать синтез коллагена и ГК широко применяется в эстетической медицине для улучшения качества кожи.
Lee Y.I. и соавт. провели двухэтапное исследование биологических эффектов пептидов коллагена на состояние возрастной кожи при топическом применении in vivo и структурно-функционального состояния фибробластов человека при инкубации клеток с пептидами коллагена in vitro [23]. Согласно полученным результатам, предварительная инкубация фибробластов с пептидами коллагена перед стрессовым воздействием (H2O2 или УФ-облучением) сопровождалась следующими эффектами по сравнению с контрольной группой:
- более низким уровнем экспрессии АФК в клеточной линии фибробластов человека;
- снижением выработки пентозидина и метилглиоксаля — двух основных биомаркеров старения;
- значительным снижением выработки гликированного коллагена, AGE и денатурированного коллагена;
- снижением уровня MMP-1, -3 и -9;
- повышением уровня коллагена I типа.
Эти результаты свидетельствуют о том, что пептиды коллагена оказывают антиоксидантное действие, препятствуют накоплению AGE, способствуют снижению уровня MMP и провоспалительных цитокинов. Отмеченные эффекты вносят важный вклад в омоложение кожи.
Edgar S. и соавт. получили схожие результаты: в ходе исследования in vitro инкубация дермальных фибробластов с пептидами коллагена на протяжении 48 ч сопровождалась повышением синтеза белков ВКМ, снижением уровня MMP-1 и -3, а также десмозина — продукта распада эластина [24]. Согласно выводам авторов, действие пептидов коллагена способствует улучшению функционального состояния дермальных фибробластов и ремоделированию дермального матрикса.
Помимо коллагена и его гидролизатов, в медицине появился рекомбинантный полипептид — α1-цепь человеческого коллагена I типа.
Karisma — инъекционный рекомбинантный полипептид коллагена для омоложения кожи
Рекомбинантная α1-цепь коллагена вырабатывается трансгенными шелкопрядами и секретируется ими в коконы. Этот рекомбинантный предшественник коллагена обладает специфическими характеристиками: он не может генерировать гомотример с тройной спиральной структурой. α1-цепь не содержит С-телопептид и С-пропептид, которые, как известно, способствуют образованию тройной спирали. Кроме того, рекомбинантная α1-цепь не подвергается посттрансляционной модификации пролилгидроксилазами и не может скручиваться, поскольку присутствие гидроксипролинов является необходимым условием для формирования стабильной тройной спирали коллагена. Вещество характеризуется крайне низким риском аллергических реакций (99,9% сходства) и 100% растворимостью при размере 100 кДа. Благодаря своей мононитевой структуре вещество сразу становится биодоступным для выработки коллагена.
Рекомбинантная α1-цепь коллагена синтезируется трансгенными шелкопрядами и имеет 99,9% сходство cколлагеном человека. Это запатентованное соединение характеризуется однородной молекулярной массой и более высоким профилем безопасности, поскольку шелкопряд не страдает от болезней, которые могут передаваться человеку, что является весомым преимуществом по сравнению с коллагеном животного происхождения.
Гидроксилированная α1-цепь рекомбинантного человеческого коллагена I типа действует как предшественник при синтезе эндогенного коллагена (рис. 6). Об этом свидетельствует подтвержденное исследование по увеличению свободного С-пептида, который образовался из проколлагена I типа после отщепления. Единственным возможным источником С-пептида является созревшая молекула коллагена, таким образом, увеличение его количества доказывает запуск процесса коллагеногенеза.
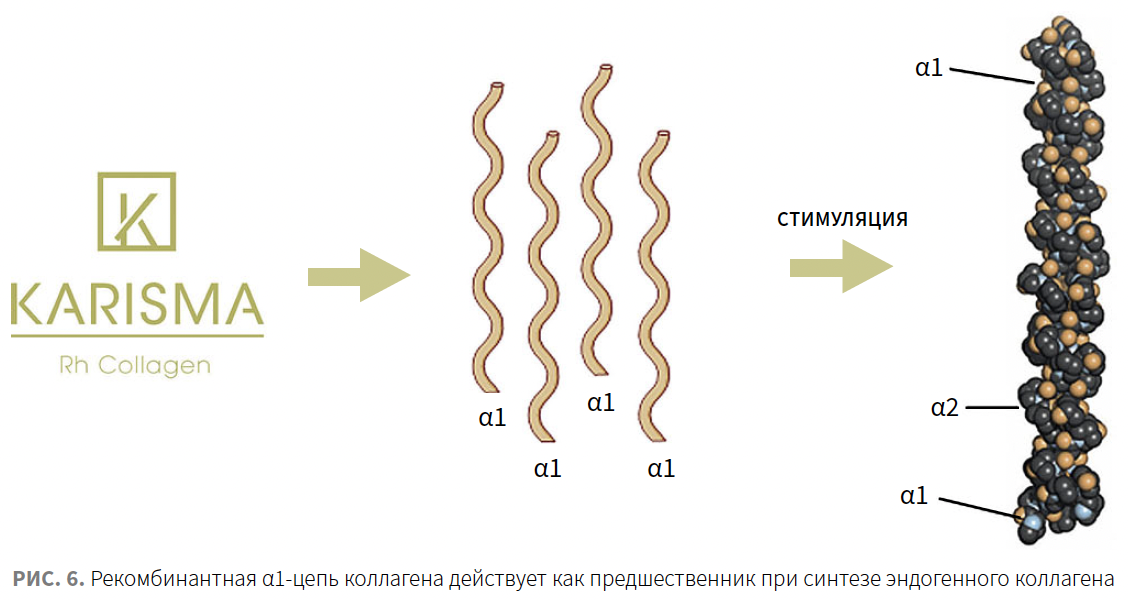
Рекомбинантная α1-цепь коллагена участвует в ряде процессов, определяющих структурно-функциональное состояние ВКМ:
- сборка коллагеновых фибрилл и других мультимерных структур;
- биосинтез и ферментативная модификации коллагена;
- организация ВКМ благодаря специфическим рецепторам;
- формирования специфических субклеточных структур, участвующих в передаче сигналов ВКМ;
- модуляция воспалительной реакции;
- активация тромбоцитов.
Таким образом, рекомбинантная α1-цепь коллагена выполняет структурообразующую функцию, служа основой для синтеза собственного коллагена, а также, подобно пептидам коллагена, которые являются сигнальными молекулами ложной деградации коллагена, обладает широким спектром биологических эффектов, нацеленных на ремоделирование ВКМ.
Рекомбинантная α1-цепь коллагена послужила основой для создания инъекционного препарата Karisma (Taumed, Рим, Италия). В состав препарата также включены ингредиенты с синергетическим действием.
Несшитая высокомолекулярная гиалуроновая кислота (20 мг/мл, 1500 кДа) участвует в создании благоприятной среды для пролиферации и метаболизма фибробластов, а также вносит фундаментальный вклад в формирование ВКМ. Благодаря своему размеру, выраженной гигроскопичности и вязкоупругости ГК участвует в обеспечении необходимой гидратации тканей, осмотического баланса и физических свойств ВКМ, модулируя оптимальную для клеток и соединительнотканных волокон среду. Ферментативное расщепление высокомолекулярных цепей на более короткие фрагменты не только позволяет повторно использовать их для синтеза de-novo, но и сопряжено с образованием фрагментов длиной 200 Да, которые непосредственно взаимодействуют со специфическим рецептором на клеточных мембранах (молекулами межклеточной адгезии 1; ICAM 1), способствуя синтезу новых компонентов ВКМ. Также эти молекулы, взаимодействуя с АФК (супероксид, перекись водорода, оксид азота, пероксинитрит), действуют в качестве нейтрализатора свободных радикалов [25].
Карбоксиметилцеллюлоза (КМЦ) — одобренный FDA водорастворимый полисахарид, полученный из целлюлозы, обладает омолаживающими свойствами за счет ингибирования гиалуронидазы, разрушающей ГК. КМЦ обеспечивает необходимую вязкость препарата и удерживает воду в тканях, что необходимо для стабильности эффекта увеличения объема и поддержания увлажненности кожи.
Оценка эффективности препарата Karisma на дермальных фибробластах взрослого и пожилого человека
Клинические эффекты биореструктуризанта Karisma были изучены в ходе исследования Augello F.R. и соавт. Для этого использовались две различные модели культивируемых фибробластов [4].
Пролиферативная активность клеток
Модель № 1 представляла собой нормальную линию клеток фибробластов взрослого человека (ФВЧ), полученную от 47-летней пациентки. Авторы использовали ее для модуляции жизнедеятельности нормальных фибробластов и обрабатывали различными концентрациями препарата Karisma (0,1, 0,5, 2, 5 и 10%, в/в) в течение 24, 48 и 72 ч.
Модель № 2 включала фибробласты человека, обработанные H2O2 в течение 1 ч для получения фенотипа фибробластов пожилого человека (ФПЧ), а затем подвергнутые воздействию Karisma. Структурно-функциональное состояние обработанных фибробластов сравнивалось с контрольными интактными ФВЧ и ФПЧ.
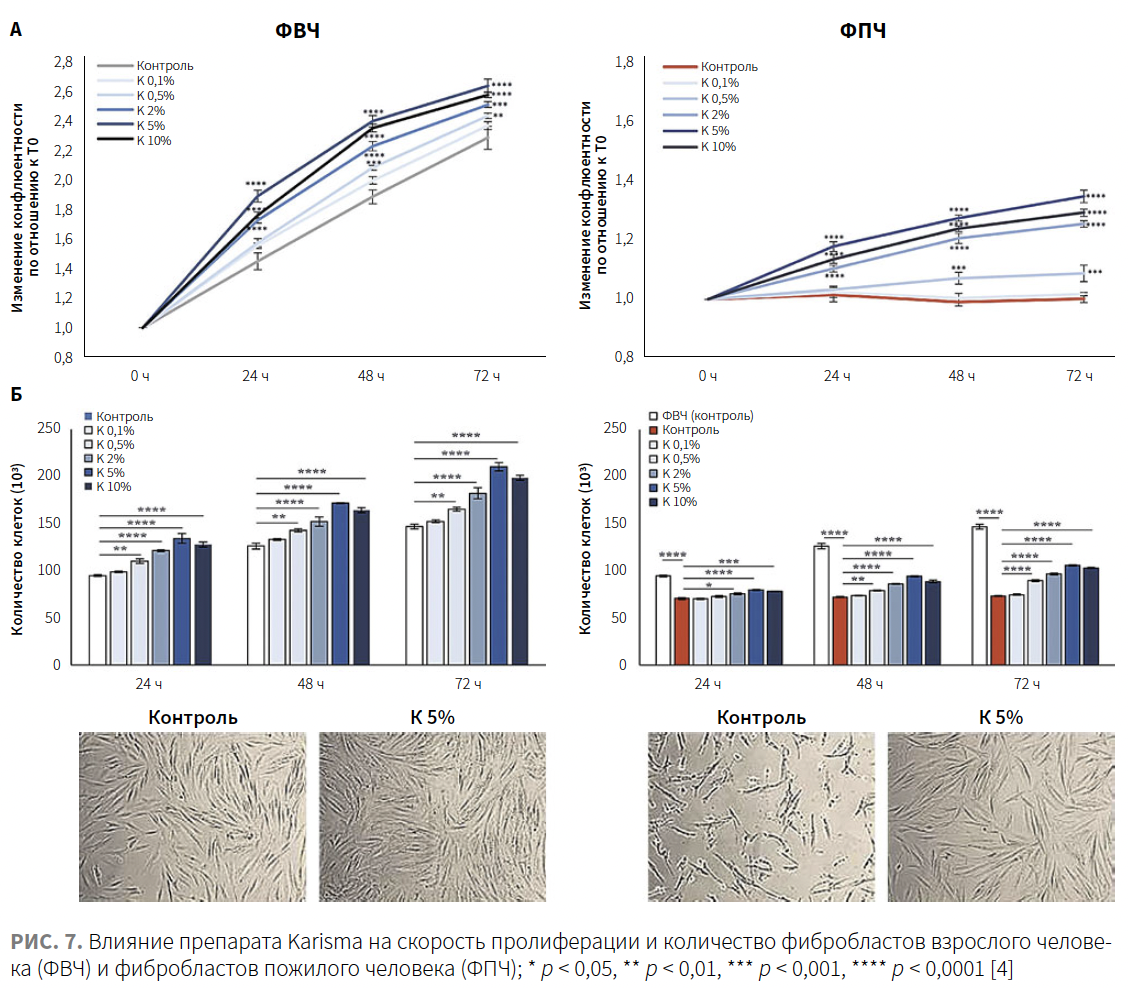
Как показано на рис. 7А, две модели значительно отличались по скорости пролиферации, оцененной путем динамического мониторинга в течение 72 ч и выраженной в виде показателя конфлюентности — степени покрытия клетками культуральной поверхности (выражается в процентах). ФВЧ (контроль) демонстрировали постепенный рост, в то время как в модели ФПЧ (контроль) конфлюентность, как и ожидалось, не увеличивалась, оставаясь постоянной с течением времени. Влияние различных концентраций (0,1, 0,5, 2, 5 и 10%) препарата Karisma на ФВЧ и ФПЧ было впервые оценено в отношении пролиферации клеток. Как показано на рис. 7А, скорость пролиферации ФВЧ, подвергшихся воздействию повышенных концентраций Karisma, увеличивалась быстрее, чем у необработанных ФВЧ (контроль). Увеличение зависело от времени и дозы, будучи статистически значимым, начиная с концентрации 0,5% Karisma.
Анализ влияния препарата Karisma на количество клеток показал сходную тенденцию в обеих моделях (рис. 7Б). Количество клеток ФВЧ всегда было значительно больше, чем ФПЧ. Воздействие препарата Karisma на ФВЧ и ФПЧ вызывало заметное увеличение числа клеток по сравнению с таковым в контрольных группах по мере увеличения времени инкубации и концентраций. Примечательно, что Karisma 5% концентрации была наиболее эффективной для индуцирования увеличения числа клеток по сравнению с необработанными клетками — как ФВЧ, так и ФПЧ (рис. 7Б). Репрезентативные изображения, полученные в результате микроскопических наблюдений за ФВЧ и ФПЧ, обработанными 5% Karisma в течение 72 ч, подтвердили увеличение числа клеток. ФПЧ казались сморщенными и морфологически отличались от ФВЧ. После обработки 5% Karisma морфология ФПЧ приблизилась к морфологии ФВЧ (рис. 7Б). Этот результат указывает на то, что препарат Karisma может противодействовать влиянию старения на скорость пролиферации, а также на морфологию клеток. На основании полученных результатов для следующих экспериментов были выбраны концентрации Karisma 0,5, 2 и 5%, наиболее эффективно стимулирующие пролиферацию фибробластов человека.
Активность бета-галактозидазы и уровнень малонового диальдегида
Чтобы исследовать влияние препарата Karisma на старение фибробластов человека, индуцированное H2O2, авторы проанализировали активность бета-галактозидазы (β-gal) — известного биомаркера старения.
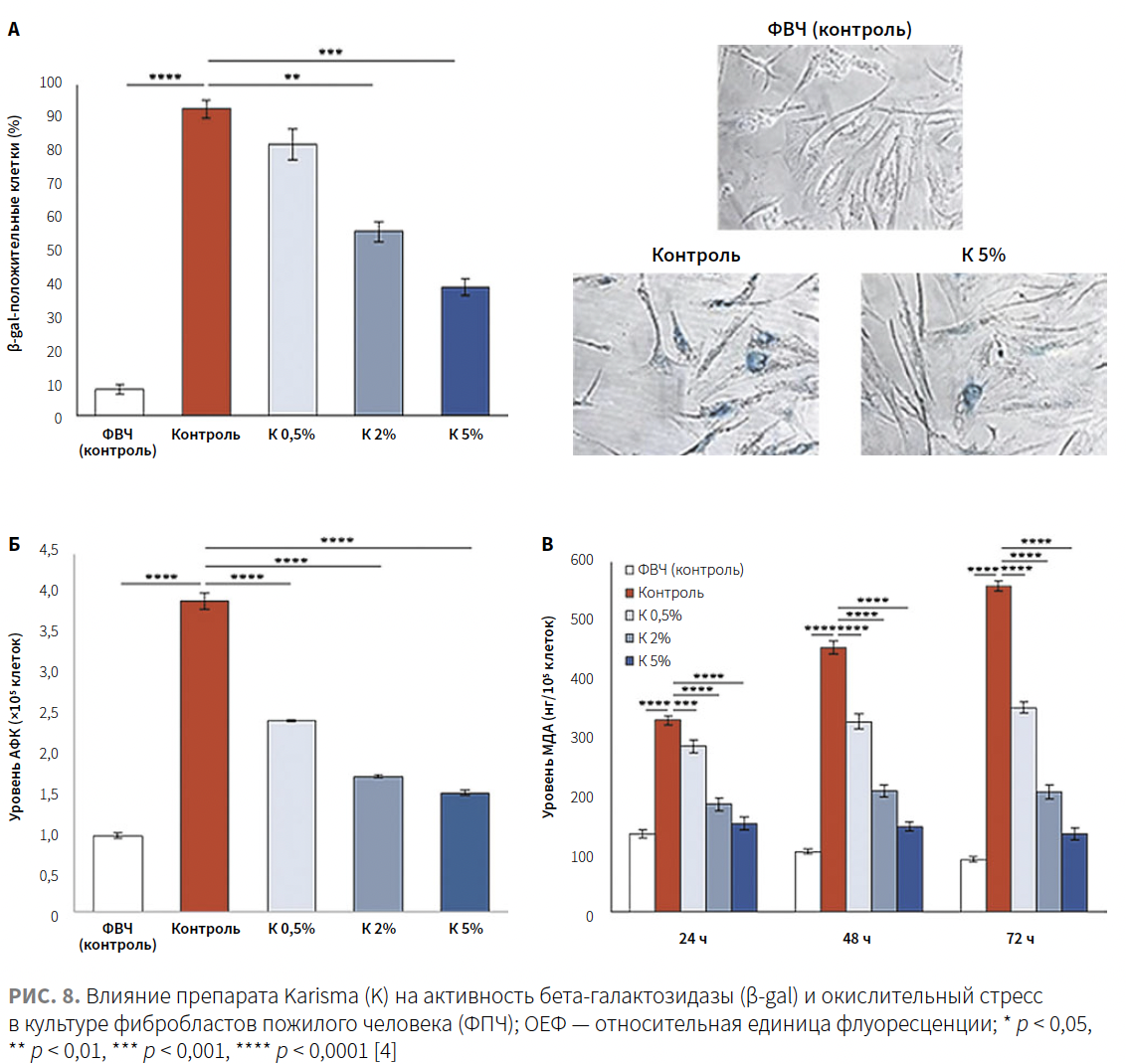
Стареющие клетки, проявляющие высокую активность β-gal, окрашиваются в синий цвет. Как показано на рис. 8А, менее 10% ФВЧ (контроль) были положительными на активность β-gal, в то время как в группе ФПЧ (контроль) этот показатель составил более 90%. Воздействие препарата Karisma в дозах 0,5, 2 и 5% позволило снизить процент положительных клеток до 82,1%, 55,7% и 39% соответственно. Наблюдаемый эффект был статистически значимым при концентрации 2 и 5% (рис. 8А).
Окислительный стресс, вызванный увеличением уровня АФК, вызывает снижение клеточной пролиферации и последующее клеточное старение [26]. Чтобы исследовать антиоксидантный эффект препарата Karisma в модели клеточного старения, вызванного H2O2 (ФПЧ), авторы оценили уровни АФК и малонового диальдегида (МДА) — маркера перекисного окисления жиров и окислительного стресса. Как показано на рис. 8Б, внутриклеточные уровни АФК были значительно выше в ФПЧ, чем в ФВЧ. Обработка препаратом Karisma значительно уменьшила их количество и уровень в зависимости от концентрации. Обработка препаратом Karisma также значительно снижала уровни МДА в зависимости от времени и концентрации (рис. 8В). Эти результаты продемонстрировали, что окислительный стресс может быть в значительной степени нейтрализован при помощи биореструктуризанта Karisma.
Уровень коллагена I типа
Исходные уровни внутриклеточного коллагена I, определяемые методом вестерн-блоттинга и иммунофлуоресценции (рис. 9А–В), были в основном ниже у ФПЧ, чем у ФВЧ.
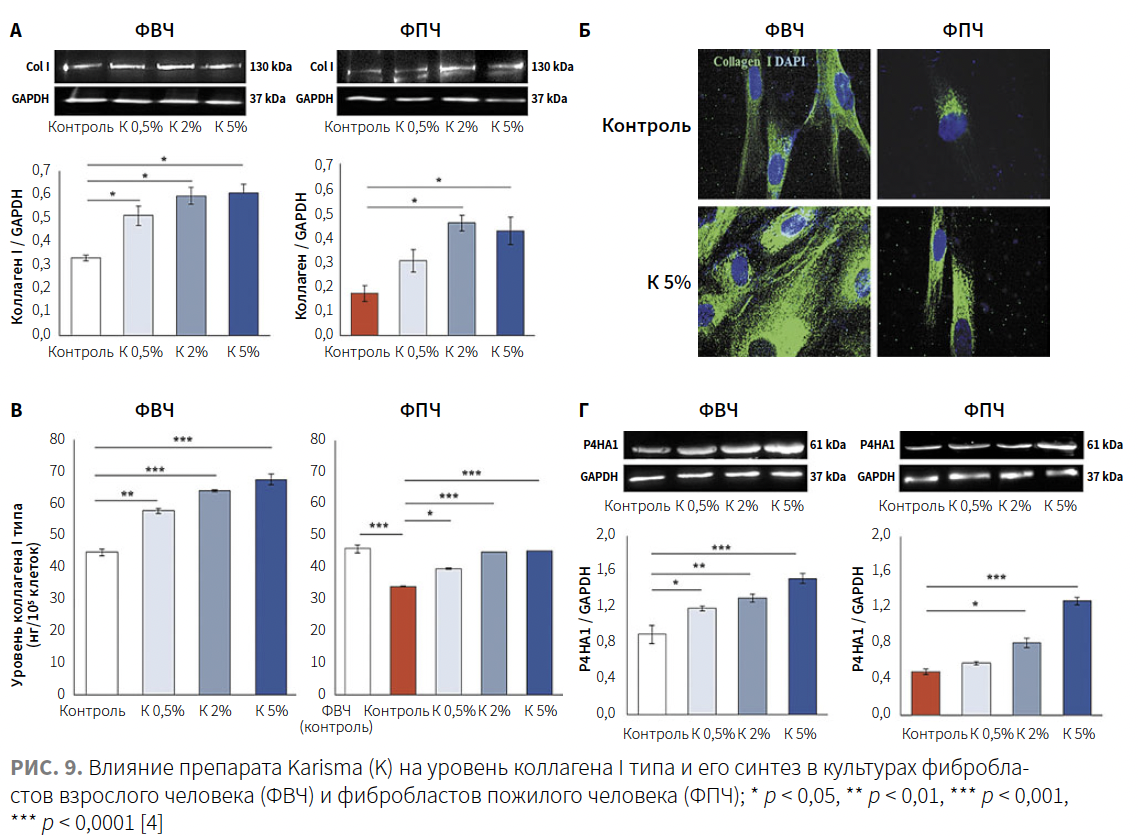
Обработка ФВЧ посредством препарата Karisma в дозах 0,5, 2 и 5% индуцировала значительное и дозозависимое увеличение внеклеточного коллагена I типа, демонстрируя показатель увеличения приблизительно на 26–32%, 40–46% и 48–52% по сравнению с контрольной группой соответственно. У ФПЧ воздействие препарата Karisma в дозах 0,5, 2 и 5% аналогичным образом индуцировало увеличение уровня внутриклеточного коллагена примерно на 15–18%, 30–35% и 30–36% по сравнению с контрольными клетками соответственно.
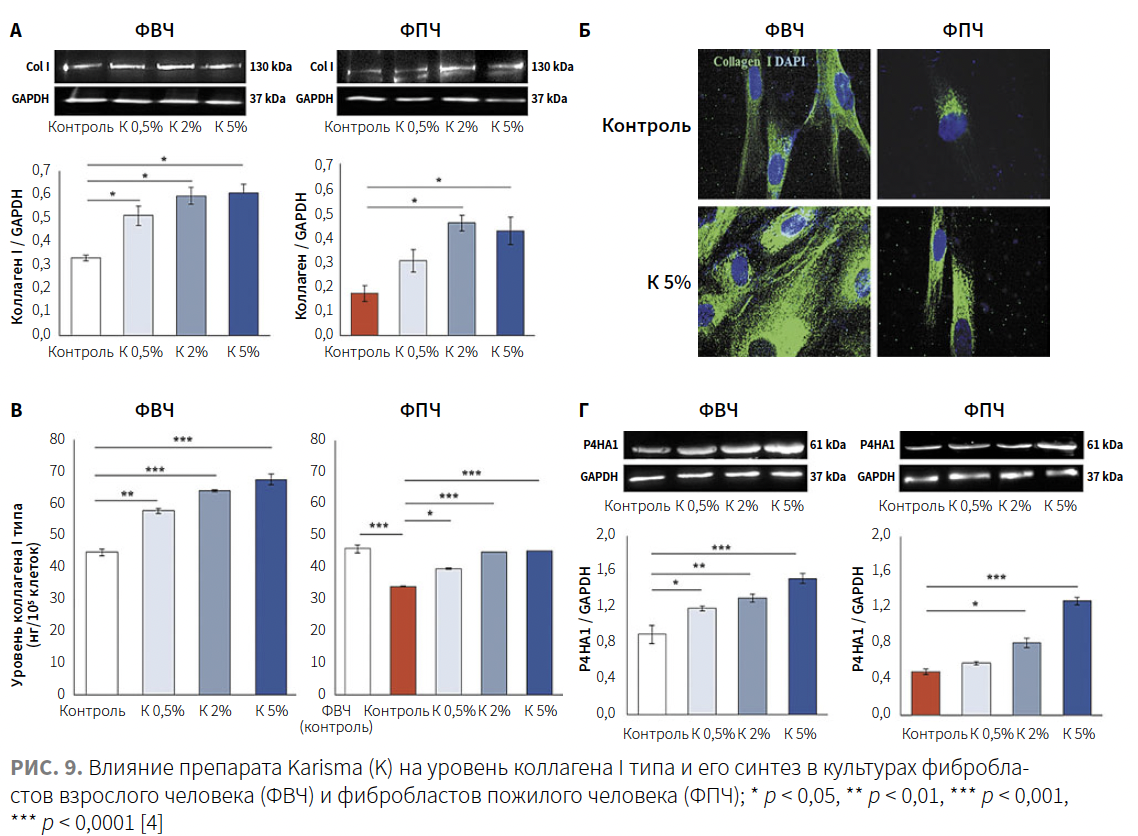
Авторы также оценили экспрессию белка пролил-4-гидроксилазы A1 (P4HA1) в культурах ФВЧ и ФПЧ, инкубированных с внесением в среду повышенной концентрации препарата Karisma на протяжении 72 ч. P4HA1 — фермент, катализирующий гидроксилирование пролина проколлагена, необходим для созревания и синтеза коллагена в фибробластах; его можно считать «лимитирующим ферментом» в выработке коллагена, поскольку уровень его экспрессии связан со скоростью синтеза коллагена (рис. 10). Как показано на рис. 9Г, исходные уровни P4HA1 в ФВЧ были выше, чем в ФПЧ. После инкубации с препаратом Karisma наблюдалось дозозависимое увеличение экспрессии P4HA1.
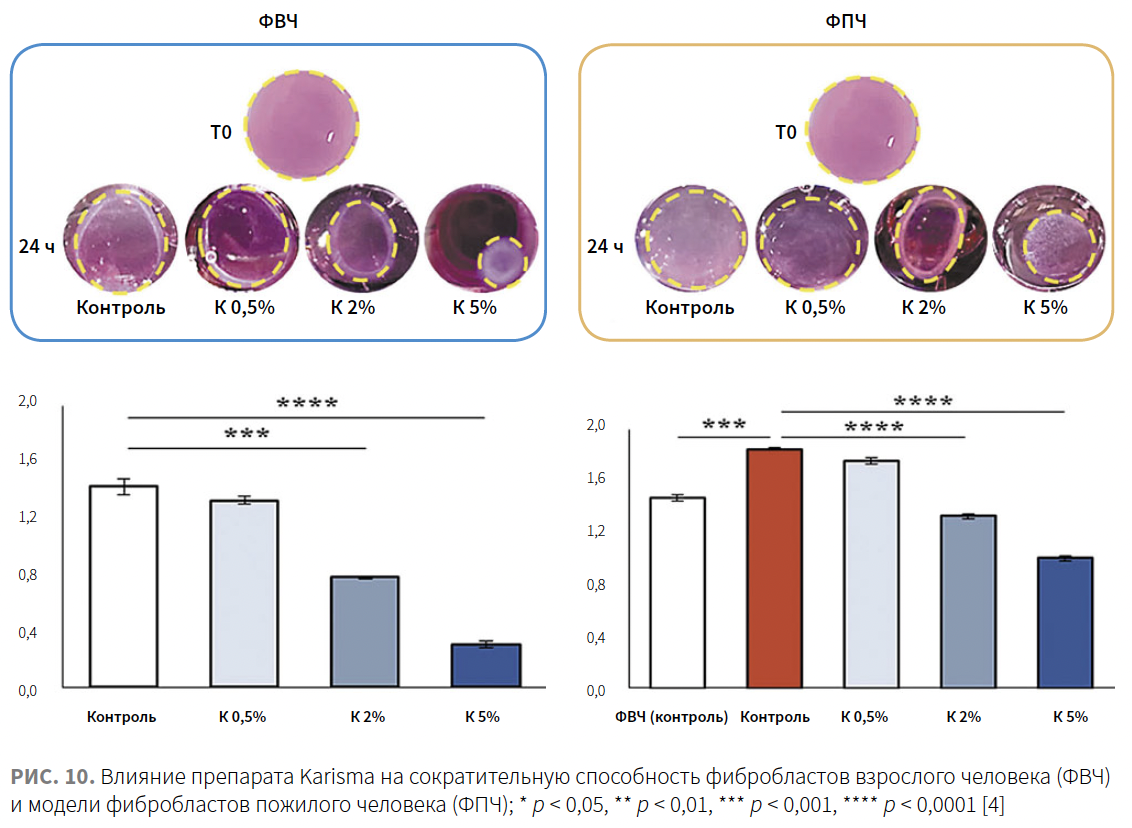
Сократительная способность фибробластов
Фибробласты экспрессируют белок α-SMA (alpha-smooth muscle actin), который участвует в обеспечении их сократительной активности. Чтобы проверить, связано ли увеличение синтеза коллагена с активностью сокращения фибробластов, авторы изучили экспрессию α-SMA в культуре ФВЧ и ФПЧ, инкубированных с препаратом Karisma. Применение препарата Karisma сопровождалось повышением экспрессии α-SMA в обеих культурах клеток.
С целью оценки влияния препарата Karisma на сократительную способность фибробластов был использован 3D-анализ сокращения коллагенового геля. Клетки высевали в трехмерный коллагеновый латекс, после полимеризации латекса добавляли готовую среду, содержащую препарат Karisma в разных концентрациях. Результаты показывают, что обработка препаратом Karisma в дозах 0,5, 2 и 5% через 24 ч привела к выраженному дозозависимому уменьшению площадей коллагеновой сети по сравнению с контрольной группой приблизительно на 5–10%, 44–47% и 78–82% соответственно. Полученные результаты указывают на способность препарата Karisma улучшать сократительную способность фибробластов, встроенных в сеть коллагеновых волокон (рис. 11).
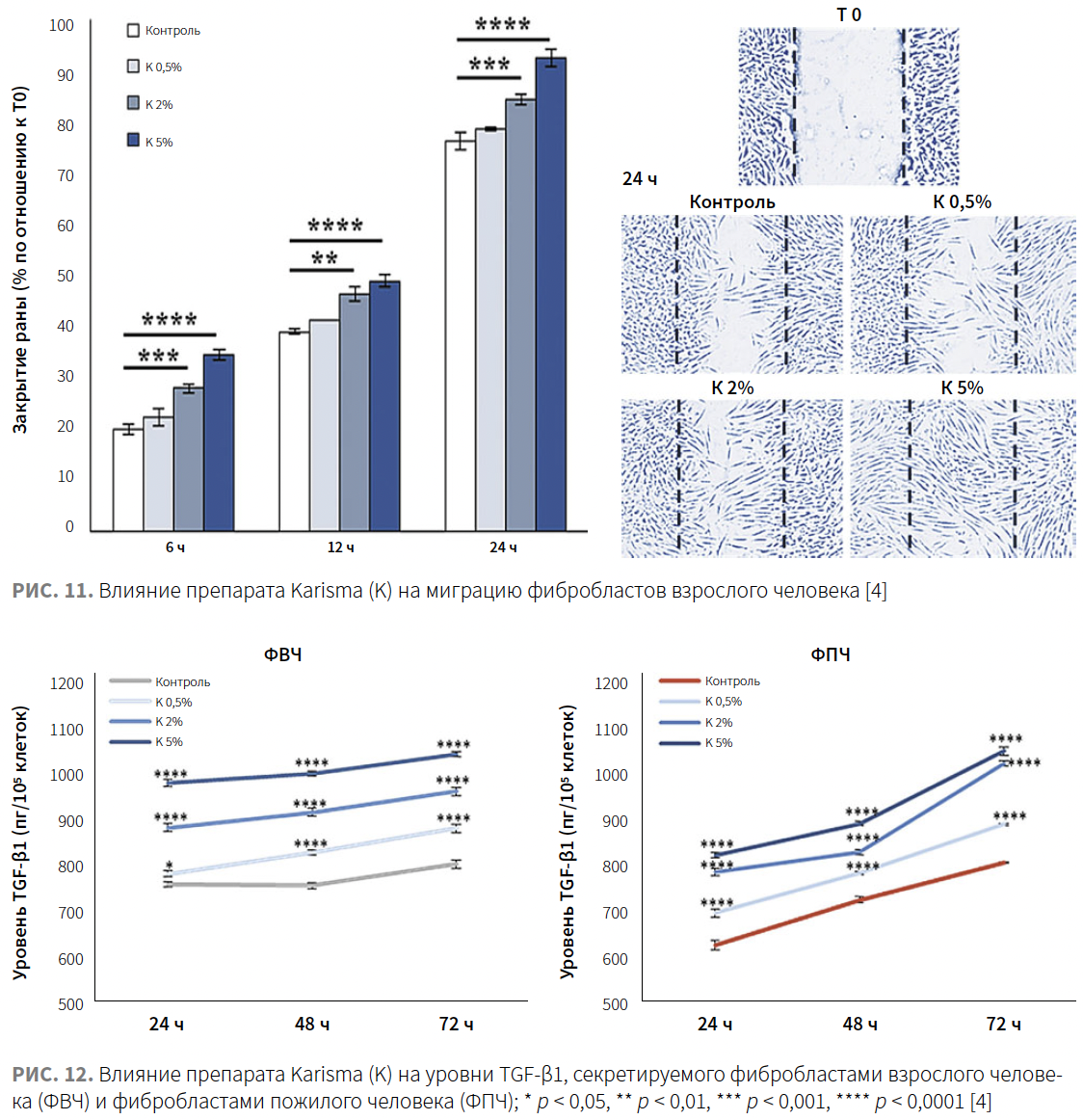
Миграционная активность фибробластов
Чтобы исследовать влияние препарата Karisma на миграцию клеток, был проведен анализ заживления ран — скорости закрытия поцарапанного монослоя в отсутствие или в присутствии препарата Karisma в концентрации 0,5, 2 или 5%. Оценивалась скорость закрытия области между краями раны. Процент закрытия через 6, 12 и 24 ч в ФВЧ, обработанных препаратом Karisma, был выше по сравнению с контрольными необработанными ФВЧ. (рис. 12).
Внеклеточная секреция TGF-β1 фибробластами
Принимая во внимание, что TGF-β1 представляет собой ключевой регулятор пролиферации фибробластов, выработки коллагена и обновления ВКМ в коже человека, авторы оценили внеклеточную секрецию TGF-β1 в культурах ФВЧ и ФПЧ, инкубированных с препаратом Karisma на протяжении 72 ч с увеличением концентрации препарата. Внесение в культуры клеток ФВЧ и ФПЧ препарата Karisma привело к повышению уровня TGF-β1 (рис. 13). Эти результаты позволили предположить, что препарат Karisma может индуцировать синтез коллагена посредством активации сигнального пути TGF-β1.
Выводы
Таким образом биореструктуризант Karisma был способен оказывать на фибробласты человека значительный дозозависимый стимулирующий эффект в отношении:
- пролиферации и миграции клеток;
- сверхэкспрессии и высвобождения коллагена I;
- сверхэкспрессии α-SMA;
- индукции ключевых белков, участвующих в биосинтезе, созревании и секреции коллагена;
- повышении сократительной способности фибробластов.
Заключение
Нежелательные явления и осложнения на введение в кожу препаратов на основе коллагена животного происхождения, такие как гранулематозное воспаление, некроз тканей и реакция гиперчувствительности, могут быть следствием аллергической реакции на белок или же на остаточные примеси. Такое нередко случалось при использовании коллагеновых средств 1-го поколения.
Новое поколение биореструктуризантов, ставшее результатом научных и клинических исследований, лишено недостатков своих предшественников. Инъекционные препараты имеют большие перспективы в области тканевой инженерии и коррекции эстетических дефектов кожи, поскольку они способны обеспечить адекватные временные условия для регенерации поврежденных тканей, а также нацелены на запуск собственных механизмов ремоделирования кожи. Таким образом, инъекционные препараты должны выполнять как структурные (т.е. роль временного наполнителя), так и биологические (прорегенеративное действие) функции. В частности, гидрогель должен не только структурно поддерживать регенерацию ткани, но и стимулировать пролиферацию фибробластов и синтез компонентов ВКМ.
Примером коллагеностимулятора нового поколения может служить Karisma, в состав которого входит комбинация таких биоактивных компонентов, как рекомбинантная α1-цепь коллагена, нативная высокомолекулярная ГК и КМЦ. Биореструктуризант Karisma способен не только физиологично восстановить утраченный в силу возрастных изменений объем мягких тканей, но также обладает выраженной способностью запускать синтез собственного коллагена I типа, противодействовать вызванному окислительным стрессом старению фибробластов и улучшать их биологическую активность. Препарат может быть использован для поддержания гомеостаза кожи, ускорения заживления ран и коррекции возрастных изменений кожи.
Литература
- Krieg T., Aumailley M. The extracellular matrix of the dermis: flexible structures with dynamic functions. Exp Dermatol 2011; 20(8): 689–695.
- Goodsell D.S. Cellular Landscapes in Watercolor. J Biocommun 2016; 40(1): e6.
- Edgar S., Hopley B., Genovese L., et al. Effects of collagen-derived bioactive peptides and natural antioxidant compounds on proliferation and matrix protein synthesis by cultured normal human dermal fibroblasts. Sci Rep 2018; 8(1): 10474.
- Augello F.R., Lombardi F., Artone S., et al. Evaluation of the Effectiveness of an Innovative Polycomponent Formulation on Adult and Aged Human Dermal Fibroblasts. Biomedicines 2023; 11(9): 2410.
- El-Domyati M., Attia S., Saleh F., et al. Intrinsic aging vs. photoaging: a comparative histopathological, immunohistochemical, and ultrastructural study of skin. Exp Dermatol 2002; 11(5): 398–405.
- Lan Y., Wang Y., Lu H. Opsin 3 is a key regulator of ultraviolet A-induced photoageing in human dermal fibroblast cells. Br J Dermatol 2020; 182(5): 1228–1244.
- Van Doren S.R. Matrix metalloproteinase interactions with collagen and elastin. Matrix Biol 2015; 46: 224–231.
- Quan T., Fisher G.J. Role of Age-Associated Alterations of the Dermal Extracellular Matrix Microenvironment in Human Skin Aging: A Mini-Review. Gerontology 2015; 61(5): 427–434.
- Kadoya K., Sasaki T., Kostka G., et al. Fibulin-5 deposition in human skin: decrease with ageing and ultraviolet B exposure and increase in solar elastosis. Br J Dermatol 2005; 153(3): 607–612.
- Rittié L., Fisher G.J. UV-light-induced signal cascades and skin aging. Ageing Res Rev 2002; 1(4): 705–720.
- Naylor E.C., Watson R.E., Sherratt M.J. Molecular aspects of skin ageing. Maturitas 2011; 69(3): 249–256.
- Wondrak G.T., Roberts M.J., Cervantes-Laurean D., et al. Proteins of the extracellular matrix are sensitizers of photo-oxidative stress in human skin cells. J Invest Dermatol 2003; 121(3): 578–586.
- Pageon H., Zucchi H., Rousset F., et al. Skin aging by glycation: lessons from the reconstructed skin model. Clin Chem Lab Med 2014; 52(1): 169–174.
- Singh R., Barden A., Mori T., Beilin L. Advanced glycation end-products: A review. Diabetologia 2001; 44(2): 129–146.
- Shigemura Y., Iwai K., Morimatsu F., et al. Effect of prolyl-hydroxyproline (pro-hyp), a food-derived collagen peptide in human blood, on growth of fibroblasts from mouse skin. J Agric Food Chem 2009; 57(2): 444–449.
- Sparavigna A. Role of the extracellular matrix in skin aging and dedicated treatment. State of the art. Plast Aesthet Res 2020; 7: 14.
- Limbert G., Masen M.A., Pond D., et al. Biotribology of the ageing skin — why we should care. Biotribology 2019; 17: 75–90.
- Salvatore L., Natali M.L., Brunetti C., et al. An Update on the Clinical Efficacy and Safety of Collagen Injectables for Aesthetic and Regenerative Medicine Applications. Polymers (Basel) 2023; 15(4): 1020.
- Wang H. A Review of the Effects of Collagen Treatment in Clinical Studies. Polymers 2021; 13(22): 3868.
- Alnojeidi H., Kilani R.T., Ghahary A. Evaluating the Biocompatibility of an Injectable Wound Matrix in a Murine Model. Gels 2022; 8(1): 49.
- Guillon C., Ferraro S., Clement S., et al. Glycation by glyoxal leads to profound changes in the behavior of dermal fibroblasts. BMJ Open Diabetes Res Care 2021; 9(1): e002091.
- Felician F.F., Yu R.H., Li M.Z., et al. The wound healing potential of collagen peptides derived from the jellyfish Rhopilema esculentum. Chin J Traumatol 2019; 22(1): 12–20.
- Lee Y.I., Lee S.G., Jung I., et al. Effect of a Topical Collagen Tripeptide on Antiaging and Inhibition of Glycation of the Skin: A Pilot Study. Int J Mol Sci 2022; 23(3): 1101.
- Edgar S., Hopley B., Genovese L., et al. Effects of collagen-derived bioactive peptides and natural antioxidant compounds on proliferation and matrix protein synthesis by cultured normal human dermal fibroblasts. Sci Rep 2018; 8(1): 10474.
- Rinaldi F., Pinto D., Trink A., et al. In vitro and in vivo Evaluation on the Safety and Efficacy of a Brand-New Intracutaneous Filler with α1-R-Collagen. Clin Cosmet Investig Dermatol 2021; 14: 501–512.
- Papaccio F., D’Arino A., Caputo S., Bellei B. Focus on the Contribution of Oxidative Stress in Skin Aging. Antioxidants 2022; 11(6): 1121.
Реклама. ООО «Медицинская компания ДЖЕС»