ВОЗМОЖНОСТИ И ПЕРСПЕКТИВЫ УСТРАНЕНИЯ МЕЛАЗМЫ ПРИ ПОМОЩИ СРЕДСТВ НА ОСНОВЕ ТРАНЕКСАМОВОЙ КИСЛОТЫ
13.09.2023
Турубара Екатерина Викторовна
Научный эксперт VICHY
Цвет кожи имеет важное значение в восприятии привлекательности, возраста и здоровья [1]. Он формируется содержащимися в коже пигментами-хромофорами, главный из которых — меланин. Именно он определяет базовый цвет. Однако основная функция пигментации вовсе не эстетическая. Поглощая различные виды излучения, пигменты защищают кожу от ультрафиолетового излучения и видимого света. В некоторых случаях защитный механизм срабатывает с погрешностями, в результате возникают различные виды гиперпигментации, связанные с избыточным накоплением меланина в эпидермисе и/или дермальном слое. Одним из самых распространенных является мелазма — симметричная приобретенная меланиновая пигментация на облучаемых солнцем участках кожи. Наиболее часто очаги мелазмы располагаются на лице и шее, реже — на разгибательных поверхностях плеч и предплечий, груди, верхней части спины [2]. Из-за сложного патогенеза, хронического течения и высокой частоты рецидивов мелазма является труднодостижимой мишенью для терапии.
От патогенеза к выбору терапевтической мишени
Недавние исследования показали, что манифестация или усугубление мелазмы происходят под влиянием широкого ряда факторов, включая генетическую предрасположенность, гормональные нарушения и воздействие ультрафиолетового излучения.
Генетическая предрасположенность
Согласно результатам исследования Kang H.Y. и соавт., при мелазме наблюдается изменение экспрессии 279 генов, задействованных в процессе меланогенеза и трансфера меланосом [3]. В аналогичном исследовании Chung B.Y. и соавт. обнаружили отличия в экспрессии 334 генов [4].
Воздействие солнечного излучения
Одним из ключевых факторов, модулирующих экспрессию генов-регуляторов меланогенеза, служит ультрафиолетовое (УФ) излучение. Оно также напрямую стимулирует меланогенез в меланоцитах.
В защитной реакции кожи на УФ-облучение задействованы не только меланоциты. Подтверждено, что паракринные связи между кератиноцитами, фибробластами и меланоцитами в коже играют важную роль в регуляции синтеза меланина в эпидермисе под воздействием УФ-излучения. Целая сеть клеточных взаимодействий между меланоцитами, кератиноцитами, тучными клетками, фибробластами, сосудами дермы и эндотелиальными клетками приводит к формированию мелазмы [5].
УФ-излучение вызывает эпидермальное высвобождение эндотелина, оксида азота, лейкотриенов и простагландинов, которые способствуют увеличению дендритов меланоцитов и усилению экспрессии гена TYR [6]. В верхней части дермы фибробласты выделяют несколько меланогенных растворимых факторов, таких как фактор роста кератиноцитов (keratinocyte growth factor; KGF), интерлейкин (ИЛ) 6, фактор некроза опухоли альфа (ФНО-α), фактор стволовых клеток (stem cell factor; SCF), основной фактор роста фибробластов (basic fibroblast growth factor; bFGF), фактор роста гепатоцитов (hepatocyte growth factor; HGF) и гранулоцитарный макрофагальный колониестимулирующий фактор (granulocyte macrophage colony-stimulating factor; GM-CSF), и вырабатывают секретируемый frizzled-родственный белок 2 (secreted frizzled related protein 2; SFRP2), регулирующий путь Wnt/βcatenin, который задействован в меланогенезе (рис. 1) [7–9].
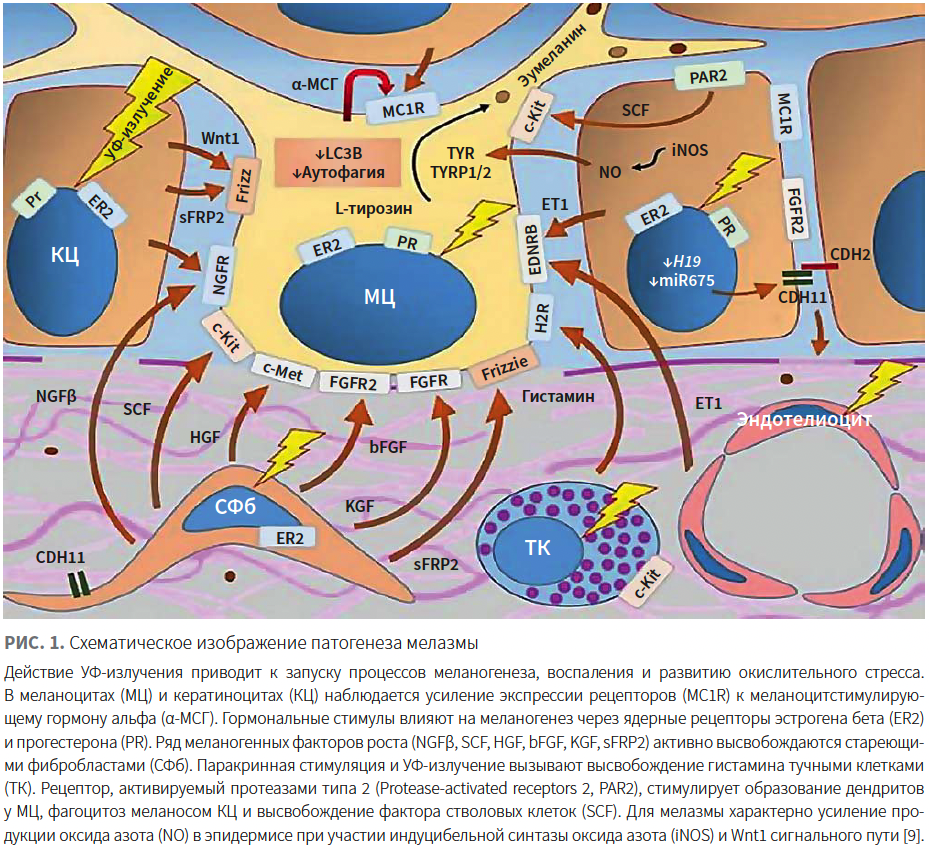
Хроническое воздействие солнца также вызывает сдвиг фибробластов в сторону стареющего фенотипа, для которого характерна активная секреция меланогенных и провоспалительных факторов [8]. Под воздействием тепловых и физических стимулов происходит дегрануляция тучных клеток с высвобождением биоактивных медиаторов, которые индуцируют меланогенез и способствуют фрагментации коллагеновых и эластиновых волокон, а также повреждению базальной мембраны — характерным структурным изменениям кожи в очагах мелазмы [9].
Кроме того, было доказано участие в патогенезе мелазмы провоспалительных медиаторов, окислительного стресса и нейроактивных молекул [10].
Окислительный стресс
Воздействие неблагоприятных факторов-стрессоров (УФ-излучение, загрязнение воздуха, физическая нагрузка и недостаток сна) приводит к образованию в коже активных форм кислорода (АФК). Более того, под воздействием УФ-излучения меланин также генерирует АФК, а меланогенез является внутриклеточным окислительным процессом [11]. В очагах мелазмы на уровне верхних слоев дермы обнаруживаются маркеры окислительного стресса, такие как усиление экспрессии p38 [12]. Степень тяжести мелазмы коррелирует с выраженностью окислительного стресса [13].
Влияние гормонального фона
Половые гормоны, такие как эстроген и особенно 17β-эстрадиол (E2), а также прогестерон, относятся к факторам, участвующим в регуляции пигментации через неклассические мембраносвязанные рецепторы [14]. Беременность, оральные контрацептивы и заместительная гормональная терапия являются наиболее часто упоминаемыми факторами, провоцирующими появление мелазмы, что подтверждает участие гормонов в патогенезе заболевания [15]. Эстрогены стимулируют меланогенез в культивируемых меланоцитах человека, запуская синтез меланогенных ферментов, таких как тирозиназа и тирозиназа-зависимые белки (Tyrp) 1 и 2 [16].
Для эпидермиса и фибробластов верхней части дермы характерно повышение экспрессии рецепторов к E2 [17].
Сосудистый фактор
На тканевом уровне в очагах мелазмы наблюдаются усиление васкуляризации, субклиническое воспаление, повышенное количество тучных клеток и периваскулярная лимфогистиоцитарная инфильтрация [18].
Еще одна характерная особенность очагов мелазмы — усиление экспрессии фактора роста эндотелия сосудов (vascular endothelial growth factor; VEGF) [19]. VEGF вырабатывается кератиноцитами после УФ-повреждения и стимулирует пролиферацию меланоцитов. Этот механизм считается одной из причин повышенной активности меланоцитов в очагах мелазмы. Более того, усиление ангиогенеза является одним из последствий УФ-облучения, поэтому сосудистые изменения в мелазме могут быть результатом избыточной инсоляции.
Можно выделить несколько мишеней для осветления кожи:
- токсическое действие на меланоциты;
- ингибирование тирозиназы, катализирующей синтез меланина и других пигментов из их предшественника тирозина;
- ингибирование процессов окисления меланина и его упаковки в меланосомы;
- отшелушивание корнеоцитов;
- уменьшение выраженности воспаления;
- защита от УФ и видимого излучения [1].
Воздействие сразу на несколько звеньев патогенеза увеличивает перспективы эффективного и долговременного устранения мелазмы.
Поиск эффективного инструмента устранения мелазмы
Топические средства относятся к первой линии терапии мелазмы. Долгое время «золотым стандартом» борьбы с гиперпигментацией считался гидрохинон. Это фенольное соединение способно воздействовать сразу на несколько звеньев патогенеза мелазмы:
- снижает активность тирозиназы;
- обладает цитотоксичным действием в отношении меланоцитов;
- повреждает меланосомы;
- обратимо угнетает синтез ДНК и РНК.
Топическое использование гидрохинона в концентрации от 2 до 4% позволяло достичь стойкой ремиссии мелазмы, однако у этого ценного эффекта была обратная сторона. Длительное применение гидрохинона ассоциировало с более высокой частотой нежелательных явлений и осложнений — аллергического и контактного дерматита, катаракты, поствоспалительной гиперпигментации, гипопигментации прилегающей неизмененной кожи, снижения эластичности кожи, пигментации ногтей, нарушения заживления ран, охраноза (огрубения и потемнения кожи на обрабатываемых гидрохиноном участках). Несмотря на введение ограничений на использование средств с гидрохиноном в разных странах (России, Европейском союзе, Австралии и некоторых африканских странах), его еще можно встретить в составе безрецептурных средств.
Неожиданная находка хирургов, заметивших, что кожа пациентов, принимающих транексамовую кислоту с антигеморрагической и антифибринолитической целью, становится светлее, послужила стимулом к более глубокому исследованию свойств транексамовой кислоты. Так в арсенале терапевтических средств для коррекции гиперпигментации появился новый козырь, быстро завоевавший доверие благодаря сочетанию эффективности и безопасности.
Свойства транексамовой кислоты и ее применение при мелазме
Транексамовая кислота (транс-4-(аминометил)циклогексанкарбоновая кислота) представляет собой синтетический аналог лизина.
Согласно имеющимся данным, транексамовая кислота обладает следующими биологическими эффектами:
- смягчает ответную реакцию кожи на действие УФ-излучения в виде пигментации за счет ингибирования плазминогена;
- ингибирует ангиогенез путем воздействия на сигнальный путь VEGF;
- пособствует снижению уровня провоспалительных сигнальных веществ — арахидоновой кислоты и простагландинов, стимулирующих меланогенез;
- снижает активность тирозиназы, продукцию меланина и препятствует пролиферации меланоцитов [20];
- стимулирует экспрессию трансформирующего фактора роста бета 1 (transforming growth factor beta 1; TGF-β1) в кератиноцитах, что впоследствии ингибирует меланогенез по паракринному сигнальному пути [21].
На сегодняшний день для терапии мелазмы успешно используются различные формы транексамовой кислоты — пероральная, топическая и внутриочаговая [1].
Системное применение транексамовой кислоты в контексте терапии мелазмы характеризуется высокой эффективностью, однако сопряжено с большим риском нежелательных явлений и осложнений (раздражение кожи, гипоменорея и др.). Тем не менее из-за своей гидрофильной структуры транексамовая кислота не может пассивно проникать в кожу. Это обстоятельство послужило стимулом к активной разработке топических форм вещества.
Результаты последних клинических исследований применения транексамовой кислоты при мелазме многообещающие (табл. 1).
Таблица 1. Обзор клинических исследований, посвященных топическому применению транексамовой кислоты при мелазме
|
Источник |
Дизайн исследования |
Результаты |
|
[22] |
22 пациента с мелазмой; топическое нанесение средства с ТК |
Улучшение индекса площади и тяжести мелазмы (Melasma Area and Severity Index; MASI) на 37%, выравнивание тона кожи между очагами мелазмы и окружающей кожей |
|
El-Husseiny R. и соавт. [23] |
Split-face исследование; 100 пациентов; на одной стороне лица — топическая форма ТК 5%; на другой стороне лица — топическая форма ГХ 4% |
После 12 нед топической терапии на обеих сторонах лица пациентов были отмечены выраженные клинические улучшения согласно индексу Hemi MASI, опроснику Качества жизни при мелазме (Melasma quality of life; MELASQOL) и среднему содержанию меланина без статистически значимой разницы. Топическое применение ТК способствовало более выраженному уменьшению площади меланина (%) и сопровождалось меньшим количеством нежелательных явлений |
|
Shamsi Meymandi S. и соавт. [24] |
60 пациентов:
|
После окончания терапии в обеих группах наблюдались значительное снижение индекса MASI, высокая удовлетворенность пациентов и высокая врачебная оценка улучшений без статистически значимой разницы между группами |
|
Lu J. и соавт. [25] |
81 пациент с мелазмой; контрольная группа |
В группе топической терапии ТК наблюдались значительное снижение индекса MASI и выравнивание тона кожи (шкала SCTS) по сравнению с контрольной группой |
|
Xu Y. и соавт. [26] |
Split-face исследование; |
Согласно оценке пациентов, на обеих сторонах лица наблюдалось выраженной улучшение. Удовлетворенность результатами была выше на стороне комбинированной терапии |
|
Atefi N. и соавт. [27] |
60 пациентов:
|
Средний индекс MASI значительно снизился в обеих группах без статистически значимой разницы. В группе А не были зафиксированы нежелательные явления, в группе Б у 10% участников отмечались эритема и раздражительный контактный дерматит. Удовлетворенность пациентов результатами была значительно выше в группе А (33,3%) по сравнению с группой Б (6,7%) |
|
Kim S.J. и соавт. [28] |
23 пациента с мелазмой; топическая форма ТК 2% |
Степень выраженности пигментации и эритемы, индекс MASI снизились значительно после 12 нед применения топической ТК |
|
Chung J.Y. и соавт. [29] |
Split-face исследование; 13 пациентов; |
К 12 нед после завершающей процедуры IPL наблюдалось значительное снижение MASI и индекса меланина (melaninindex; MI) на стороне применения ТК. Частота возобновления мелазмы после IPL-терапии также была существенно ниже на стороне применения ТК |
|
Banihashemi M. и соавт. [30] |
Split-face исследование; 23 пациента; топическая ТК в сравнении с ГХ |
Средний показатель MASI значительно снизился с обеих сторон после 12 нед терапии. Более выраженные клинические улучшения наблюдались при использовании ТК, хотя эта разница не была статистически значимой. Раздражительный контактный дерматит возник у 3 пациентов при использовании ГХ, в то время как при использовании ТК серьезных нежелательных явлений не наблюдалось |
|
Ebrahimi B. и соавт. [31] |
Split-face исследование; 39 пациентов; 3% ТК в сравнении с 3% ГХ + 0,01% дексаметазон |
Отсутствие статистически значимых отличий в удовлетворенности пациентов и врачебной оценке улучшений между двумя группами |
Примечание. ТК — транексамовая кислота; ГХ — гидрохинон.
В приведенных исследованиях топическое применение транексамовой кислоты характеризовалось выраженными клиническими улучшениями и отсутствием нежелательных явлений. Транексамовая кислота не уступала гидрохинону в эффективности, имея при этом более высокий профиль безопасности.
Сыворотки LIFTACTIV SPECIALIST B3 — синергия ингредиентов для устранения мелазмы
На основе транексамовой кислоты компания VICHY (Vichy laboratoires, Франция) разработала сыворотку LIFTACTIV B3. Ее основная миссия — выравнивание тона кожи и устранение пигментных пятен. Транексамовая кислота охватывает действием все основные звенья патогенеза мелазмы — препятствует увеличению количества меланоцитов, синтезу меланина и ангиогенезу. Эффекты транексамовой кислоты усиливают и дополняют другие компоненты LIFTACTIV B3. Транексамовая кислота и ниацинамид входят в последние клинические рекомендации по лечению мелазмы и поствоспалительной гиперпигментации Российского общества дерматовенерологов и косметологов.
Ниацинамид — биологически активная форма ниацина (витамина B3), является важным компонентом коферментной системы организма. Ниацинамид необходим для удержания влаги, поддержания липидного баланса и восстановления вызванных УФ-излучением повреждений ДНК. Также ниацинамид выполняет функцию ингибитора трансфера меланосом к кератиноцитам [32].
Витамин C препятствует синтезу меланина посредством снижения активности тирозиназы, ингибирует выработку свободных радикалов, запускающих меланогенез, а также обладает фотозащитным действием — предотвращает поглощение УФ-излучения [33].
Для бережного удаления клеток эпидермиса с повышенным содержанием меланина в состав LIFTACTIV B3 входят пилинговые компоненты:
- 1,5% гликолевая кислота ослабляет сцепление между корнеоцитами, обеспечивает равномерную эксфолиацию рогового слоя, ускоряя тем самым выделение меланина;
- комплекс HEPES стимулирует активность протеаз — естественных ферментов, участвующих в десквамации рогового слоя;
- 2,2% мочевина увлажняет кожу, обеспечивает естественную эксфолиацию рогового слоя.
Эффективность сыворотки по сравнению с гидрохиноном была оценена в ходе двойного слепого исследования.
В состав выборки были включены 65 женщин в возрасте 20–50 лет с II–VI фототипами кожи, имеющих проявления мелазмы более 1 года. Пациенты были разделены на две терапевтические группы (табл. 2).
Таблица 2. Характеристика терапевтических групп
|
Число участников |
Терапевтическая схема |
Длительность терапии |
|
Группа 1: n = 33 |
Топическое нанесение сыворотки LIFTACTIV B3 утром и вечером + солнцезащитное средство утром |
5 мес |
|
Группа 2: n = 32 |
Топическое нанесение нейтрального крема утром и 4% гидрохинона вечером +солнцезащитное средство |
3 мес |
|
Топическое нанесение сыворотки LIFTACTIV B3 утром и вечером + солнцезащитное средство утром |
2 мес |
Для оценки результатов использовались следующие показатели:
- MASI;
- общая врачебная оценка выраженности симптомов заболевания (Investigator’s Global Assessment; IGA);
- общая оценка эффективности пациентом и врачом;
- общая оценка переносимости пациентом / опросник косметической приемлемости;
- опросник качества жизни при мелазме (MelasQOL);
- клинические снимки и УФ-снимки с помощью ColorFace®
- инструментальные измерения.
Результаты
В обеих терапевтических группах наблюдалось стабильное снижение показателей MASI и mMASI без существенной межгрупповой разницы (рис. 2, 3).
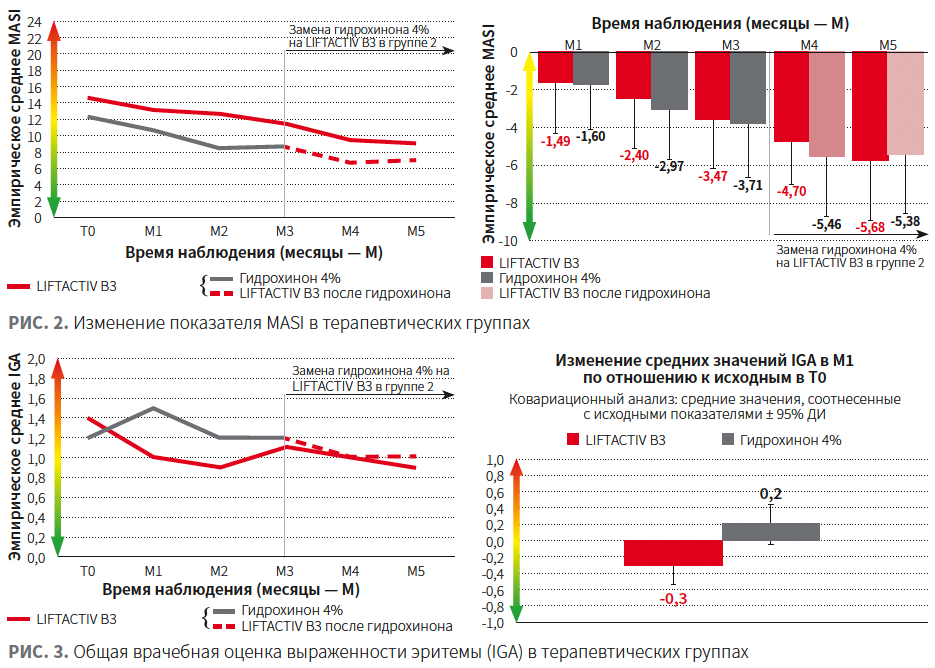
Клиническая выраженность эритемы (IGA), согласно врачебной оценке, была значительно ниже в группе применения LIFTACTIV SPECIALIST B3 (рис. 4). Следует отметить, что в группе 2 после смены топического средства с гидрохинона 4% на LIFTACTIV SPECIALIST B3 произошло прогрессивное снижение показателя IGA.
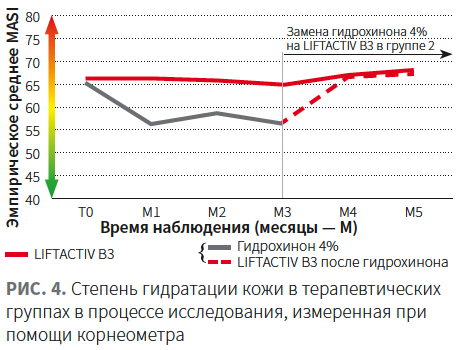
Применение LIFTACTIV SPECIALIST B3 обеспечивало более высокую степень гидратации кожи по сравнению с гидрохиноном (рис. 5).
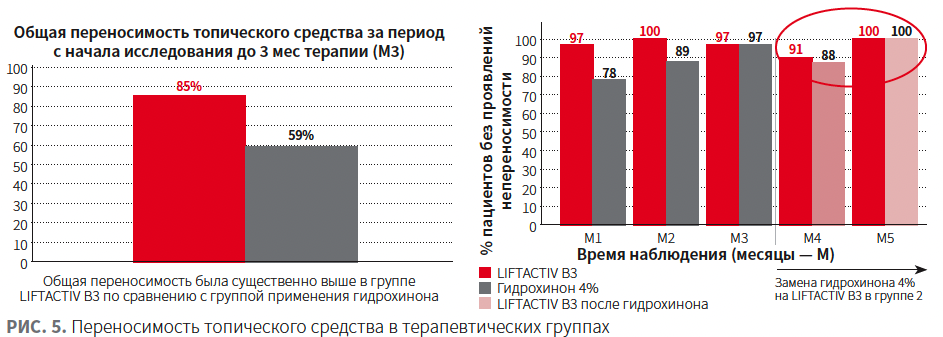
Переносимость средства и качество жизни пациентов были выше в группе применения гидрохинона (рис. 6, 7).
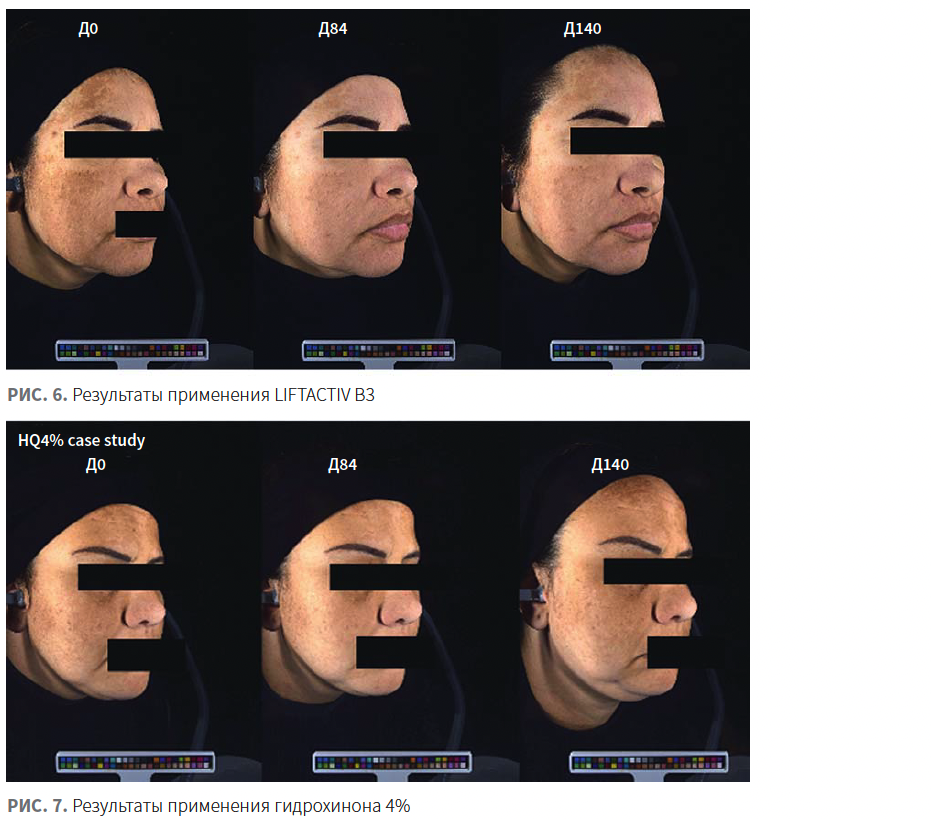
Таким образом, применение LIFTACTIV SPECIALIST B3 характеризовалось:
- клинической эффективностью, не уступающей гидрохинону 4% согласно индексам MASI и mMASI (рис. 7);
- более высокой переносимостью / отсутствием раздражения начиная с 1 мес;
- поддержанием более высокой степени гидратации кожи.
Замена гидрохинона 4% в группе 2 на LIFTACTIV SPECIALIST B3 после 3 мес терапии обеспечила:
- ту же клиническую эффективность;
- отсутствие рецидива мелазмы;
- повышение степени гидратации кожи до значений на 3 мес терапии LIFTACTIV SPECIALIST B3;
- улучшение переносимости до значений на 3 мес терапии LIFTACTIV SPECIALIST B3;
- сохранение достигнутых результатов.
Крем и сыворотка LIFTACTIV SPECIALIST — комплексный уход против фотостарения
Следует отметить, что пигментные нарушения — только одно из проявлений фотостарения. Действие УФ-излучения драматично сказывается на состоянии коллагеновых и эластиновых волокон. Для запуска ремоделирования и уплотнения дермы в состав сыворотки включены коллагеновые пептиды, стимулирующие синтез коллагена III типа, эластина и гликозаминогликанов (рис. 8). Однако для усиления омолаживающего эффекта сыворотку LIFTACTIV SPECIALIST B3 рекомендуется применять совместно с кремом LIFTACTIV B3 ANTI-DARK SPOTS SPF 50. Помимо солнцезащитных фильтров и ниацинамида, препятствующих появлению пигментации, крем содержит пептиды риса и матриксил, значительно усиливающие синтез коллагена, что обеспечивает уменьшение выраженности морщин, повышение тонуса кожи и ремоделирование овала лица.

Заключение
Мелазма — частый спутник кожи, находящейся в условиях повышенной инсоляции, смены гормонального фона или психоэмоционального стресса. Современная наука обеспечила врача широкой палитрой топических средств и косметологических процедур, позволяющих остановить или частично успокоить избыточную адаптивную реакцию кожи в виде гиперпигментации.
Топические средства служат оптимальным инструментом коррекции гиперпигментации и могут использоваться как на этапе профессионального ухода, так и в домашних условиях. Необходимо подобрать топическое средство, позволяющее устранить очаги мелазмы при отсутствии нежелательных явлений.
Согласно рассмотренным исследованиям, средства на основе транексамовой кислоты обеспечивают эффективную коррекцию гиперпигментации и не обладают раздражающим действием, что расширяет возможности их применения.
Сыворотка LIFTACTIV SPECIALIST B3 служит прекрасным примером комплексного средства против мелазмы, нацеленного на основные звенья патогенеза гиперпигментации. LIFTACTIV SPECIALIST B3 можно рекомендовать к ежедневному применению при наличии склонности к пигментным нарушения, в рамках терапии мелазмы в комплексе с солнцезащитными средствами, а также для профилактики поствоспалительной гиперпигментации на этапах подготовки к малоинвазивным косметологическим процедурам и последующей реабилитации.
Литература
- ПИГМЕНТАЦИЯ В ПРАКТИКЕ КОСМЕТОЛОГА / под общ. ред. Е.И. Эрнандес, Е.М. Раханской. М.: ООО ИД «Косметика и медицина», 2020. 172 с.
- Desai S.R., Chan L.C., Handog E., et al. Optimizing melasma management with topical tranexamic acid: An expert consensus. JDrugs Dermatol 2023; 22(4): 386–392.
- Kang H.Y., Suzuki I., Lee D.J., Ha J., et al. Transcriptional profiling shows altered expression of Wnt pathway- and lipid metabolism-related genes as well as melanogenesis-related genes in melasma. J Invest Dermatol 2011; 131(8): 1692–1700.
- Chung B.Y., Noh T.K., Yang S.H., et al. Gene expression profiling in melasma in Korean women. Dermatology 2014; 229(4): 333–342.
- Passeron T., Picardo M. Melasma, a photoaging disorder. Pigment Cell Melanoma Res 2018; 31(4): 461–465.
- Kang H.Y., Hwang J.S., Lee J.Y., et al. The dermal stem cell factor and c-kit are overexpressed in melasma. Br J Dermatol 2006; 154(6): 1094–1099.
- Kim M., Han J.H., Kim J.H., et al. Secreted frizzled-related protein 2 (sFRP2) functions as a melanogenic stimulator; the role of sFRP2 in UV-induced hyperpigmentary disorders. J Invest Dermatol 2016; 136(1): 236–244.
- Kim M., Kim S.M., Kwon S., et al. Senescent fibroblasts in melasma pathophysiology. Exp Dermatol 2019; 28(6): 719–722.
- Espósito A.C.C., Cassiano D.P., da Silva C.N., et al. Update on Melasma-Part I: Pathogenesis. Dermatol Ther (Heidelb) 2022;12(9): 1967–1988.
- Liu W., Chen Q., Xia Y. New Mechanistic Insights of Melasma. Clin Cosmet Investig Dermatol 2023; 16: 429–442.
- Siiskonen H., Smorodchenko A., Krause K., Maurer M. Ultraviolet radiation and skin mast cells: Effects, mechanisms and relevance for skin diseases. Exp Dermatol 2018; 27(1): 3–8.
- Denat L., Kadekaro A.L., Marrot L., et al. Melanocytes as instigators and victims of oxidative stress. J Invest Dermatol 2014; 134(6): 1512–1518.
- Esposito A.C.C, Brianezi G., de Souza N.P., et al. Exploring pathways for sustained melanogenesis in facial melasma: an immunofluorescence study. Int J Cosmet Sci 2018; 40(4): 420–424.
- Natale C.A., Duperret E.K., Zhang J., et al. Sex steroids regulate skin pigmentation through nonclassical membrane-bound receptors. Elife 2016; 5: e15104.
- Handel A.C., Lima P.B., Tonolli V.M., et al. Risk factors for facial melasma in women: a case-control study. Br J Dermatol 2014; 171(3): 588–594.
- Filoni A., Mariano M., Cameli N. Melasma: how hormones can modulate skin pigmentation. J Cosmet Dermatol 2019; 18(2): 458–463.
- Esposito A.C.C, Brianezi G., Miot L.D.B., Miot H.A. Morphology, growth rate and gene expression of fibroblasts in facial melasma. An Bras Dermatol 2022; 97(5): 575–582.
- Kwon S.H., Hwang Y.J., Lee S.K., Park K.C. Heterogeneous pathology of melasma and its clinical implications. Int J Mol Sci 2016; 17(6): 824.
- Byun J.W., Park I.S., Choi G.S., Shin J. Role of fibroblast-derived factors in the pathogenesis of melasma. Clin Exp Dermatol 2016; 41(6): 601–609.
- Zhu J.W., Ni Y.J., Tong X.Y., et al. Tranexamic Acid Inhibits Angiogenesis and Melanogenesis in Vitro by Targeting VEGF Receptors. Int J Med Sci 2020; 17(7): 903–911.
- Xing X., Xu Z., Chen L., et al. Tranexamic acid inhibits melanogenesis partially via stimulation of TGF-β1 expression in human epidermal keratinocytes. Exp Dermatol 2022; 31(4): 633–640.
- Data on file. Evaluation on the lightening effect on melasma area of a cosmetic product. DermScan Asia. February 2020.
- El-Husseiny R., Rakha N., Sallam M. Efficacy and safety of tranexamic acid 5% cream vs hydroquinone 4% cream in treating melasma: A split-face comparative clinical, histopathological, and antera 3D camera study. Dermatol Ther 2020; 33(6): e14240.
- Shamsi Meymandi S., Mozayyeni A., Shamsi Meymandi M., Aflatoonian M. Efficacy of microneedling plus topical 4% tranexamic acid solution vs 4% hydroquinone in the treatment of melasma: A single-blind randomized clinical trial. J Cosmet Dermatol 2020; 19(11): 2906–2911.
- Lu J., Yang L., Xu P., et al. Whitening efficacy of tranexamic acid cataplasm on melasma in Chinese women. Integr Med Int 2017; 4(3-4): 154–160.
- Xu Y., Ma R., Juliandri J., et al. Efficacy of functional microarray of microneedles combined with topical tranexamic acid for melasma: a randomized, self- controlled, split-face study. Medicine (Baltimore) 2017; 96(19): e6897.
- Atefi N., Dalvand B., Ghassemi M., et al. Therapeutic Effects of Topical Tranexamic Acid in Comparison with Hydroquinone in Treatment of Women with Melasma. Dermatol Ther (Heidelb) 2017; 7(3): 417–424.
- Kim S.J., Park J.Y., Shibata T., et al. Efficacy and possible mechanisms of topical tranexamic acid in melasma. Clin Exp Dermatol 2016; 41(5): 480–485.
- Chung J.Y., Lee J.H., Lee J.H. Topical tranexamic acid as an adjuvant treatment in melasma: side-by-side comparison clinical study. J Dermatolog Treat 2016; 27(4): 373–377.
- Banihashemi M., Zabolinejad N., Jaafari M.R., et al. Comparison of therapeutic effects of liposomal tranexamic acid and conventional hydroquinone on melasma. J Cosmet Dermatol 2015; 14(3): 174–177.
- Ebrahimi B., Naeini F.F. Topical tranexamic acid as a promising treatment for melasma. J Res Med Sci 2014; 19(8): 753–757.
- Hakozaki T., Minwalla L., Zhuang J., et al. The effect of niacinamide on reducing cutaneous pigmentation and suppression of melanosome transfer. Br J Dermatol 2002; 147(1): 20–31.
- Murphy M.J., Dow A.A. Natural Cosmeceutical Ingredients for the Management of Hyperpigmentation in Hispanic and Latino Women. JClin Aesthet Dermatol 2021; 14(8): 52–56.