ЯТРОГЕННАЯ ПОСТВОСПАЛИТЕЛЬНАЯ ГИПЕРПИГМЕНТАЦИЯ: КАК ПРЕДОТВРАТИТЬ ОСЛОЖНЕНИЕ НА ЭТАПЕ ПОДГОТОВКИ К ПРОЦЕДУРЕ
06.12.2022
ШАРОВА Алиса Александровна
Кандидат медицинских наук, врач-косметолог, гериатр, доцент кафедры реконструктивной и пластической хирургии, косметологии и клеточных технологий РНИМУ им. Н.И. Пирогова, руководитель направления "Косметология", научный руководитель Центра Эстетической Медицины "Чистые пруды". (Москва)
Поствоспалительная гиперпигментация (ПВГП) — приобретенное нарушение пигментации, возникающее на месте воспалительного процесса (воспалительные и инфекционные дерматозы, кожные проявления аутоиммунных и аллергических заболеваний, реакция на прием препаратов), а также повреждения кожи разной этиологии [1].
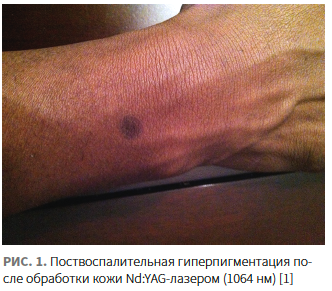
Особое внимание необходимо уделить ятрогенному типу ПВГП (рис. 1). В этом случае триггером развития пигментных нарушений служит контролируемое повреждение кожи посредством малоинвазивных косметологических методов коррекции:
- дермабразии;
- криотерапии;
- лазерного излучения;
- интенсивного импульсного света;
- химических пилингов;
- микроигольчатой терапии.
Согласно выводам авторов, выбор параметров воздействия в соответствии с клинической картиной и фототипом кожи пациента, а также предпроцедурная подготовка кожи с помощью топических средств являются важными мерами снижения риска ПВГП. Для выбора эффективного топического ухода в рамках подготовки к малоинвазивным косметологическим процедурам необходим научно обоснованный подход. В первую очередь следует определиться с терапевтическими мишенями — звеньями патогенеза гиперпигментации, воздействуя на которые при помощи активных ингредиентов можно предотвратить процесс избыточного отложения пигмента в самой начальной фазе.
В табл. 1 приведен обзор научных публикаций, затрагивающих проблему возникновения ПВГП после малоинвазивных косметологических процедур.
Таблица 1. Поствоспалительная гиперпигментация после малоинвазивных косметологических процедур: обзор клинических исследований
|
Авторы |
Основные результаты |
Выводы |
|
Неаблятивные фракционные лазеры |
||
|
Alexis A.F. и соавт. [2] |
В ходе исследования была оценена частота возникновения ПВГП у пациентов с темными фототипами кожи после применения Er:glass-лазера (1550 нм) для коррекции рубцов постакне. При низкой плотности энергии лазерного излучения ПВГП возникла у 43% пациентов, при высокой плотности — у 71% пациентов, даже несмотря на предпроцедурное применение гидрохинона 4% |
При высокой плотности энергии лазерного излучения риск возникновения ПВГП значительно повышается. Хотя неаблятивное фракционное воздействие считается безопасным и эффективным для всех типов кожи, при темных фототипах риск развития ПВГП значительно возрастает |
|
Kono T. и соавт. [3] |
После применения фракционного Er:glass-лазера (1550 нм) для омоложения кожи наблюдалось развитие ПВГП у 6,7% пациентов с III–IV фототипами кожи. Использование высокой плотности энергии было сопряжено с более высоким риском развития ПВГП |
|
|
Лазеры с модуляцией добротности |
||
|
Kang H.J. и соавт. [4] |
После применения QS-Nd:YAG-лазера для коррекции солнечных лентиго у пациентов с III и IV фототипами кожи наблюдалось развитие ПВГП у 20,3% участников. Авторы отметили интересную особенность — у пациентов с гладкой кожей и невидимыми порами ПВГП возникала чаще, чем у пациентов с более грубой текстурой кожи и расширенными порами |
Подобно фракционным лазерам, QS-лазеры безопасны для использования у различных групп пациентов, однако параметры воздействия должны быть адаптированы к фототипу кожи. При темных фототипах кожи сохраняется риск развития ПВГП |
|
Negishi K. и соавт. [5] |
Авторы использовали Nd:YAG-лазер (532 нм) и рубиновый лазер (694 нм) с модуляцией добротности для коррекции солнечных лентиго у 193 пациентов с III–V фототипами кожи. Авторы сопоставили риски нежелательных явлений при разной методике обработки: в двух терапевтических группах обработку проводили более агрессивно, до выраженного эффекта отбеливания пигментного образования, в оставшихся двух группах — до легкого эффекта отбеливания. В группах с более агрессивными параметрами воздействия ПВГП возникла у 23,18–33,33% пациентов, более деликатная лазерная обработка вызвала развитие ПВГП лишь у 7,47–8,47% |
|
|
Аблятивные лазеры |
||
|
Tanzi E.L. иAlster T.S. [6] |
Авторы применили двухрежимный Er:YAG-лазер для коррекции рубцов постакне средней и тяжелой степени у пациентов с I–V фототипами кожи. ПВГП встречалась у 44% пациентов, большинство из которых имели более темный фототип кожи |
Аблятивные лазеры следует использовать с осторожностью у пациентов с более темными фототипами кожи из-за высокого риска ПВГП |
|
Tanzi E.L. иAlster T.S. [7] |
При использовании Er:YAG-лазера с переменной величиной импульса и несколькими проходами для коррекции признаков фотостарения, морщин и атрофических рубцов ПВГП возникала у 40% пациентов. Для ее разрешения потребовалось в среднем 10,4 нед с использованием местных депигментирующих средств и поверхностных химических пилингов |
|
|
Nanni C.A. иAlster T.S. [8] |
При ретроспективном анализе медицинских карт 500 пациентов (I–Vфототипы кожи), прошедших шлифовку CO2-лазером, общая частота ПВГП составила 37%, у пациентов с IV и V фототипами — 100% |
|
|
Химические пилинги |
||
|
Kodali S. и соавт. [9] Abdel Meguid A.M. и соавт. [10] |
Малочисленные исследования проведения пилингов с 20–30% салициловой кислотой у пациентов с III–V фототипами кожи, включая лиц азиатского, латиноамериканского и афроамериканского происхождения, не продемонстрировали случаев ПВГП |
Поверхностные химические пилинги обычно связаны с низким риском ПВГП при оптимальной концентрации активного вещества и продолжительности пилинга. Срединные и глубокие химические пилинги с большей вероятностью вызывают ПВГП у пациентов с темными фототипами кожи. Использование отбеливающих топических средств на этапе подготовки к процедуре способно снизить частоту ПВГП [13, 14] |
|
Grimes P.E. исоавт. [11] |
После проведения пилинга с 35% салициловой кислотой у пациентов с IV–VI фототипами кожи наблюдалось развитие ПВГП в 12% случаев. Гиперпигментация разрешалась в течение 7–10 дней и реже возникала у тех, кто одновременно наносил топически гидрохинон |
|
|
Sarkar R. и соавт. [12] |
У пациентов с темными фототипами кожи частота развития ПВГП после пилинга с 35–50% гликолевой кислотой составляет порядка 7,5–20% |
|
|
Микронидлинг |
||
|
Majid I. [15] Fabbrocini G. и соавт. [16] |
В нескольких исследованиях авторами не было отмечено случаев возникновения ПВГП при использовании микронидлинга для коррекции рубцов постакне, в других сообщалось о развитии ПВГП в 14% случаев |
Самая высокая частота ПВГП после микронидлинга наблюдалась у пациентов с более темными фототипами кожи. Комбинация микронидлинга и химического пилинга сопряжена с меньшим риском ПВГП |
|
Sharad J. [17] |
Комбинация микронидлинга и химического пилинга с 30% гликолевой и 20% трихлоруксусной кислотами связана с более низким риском ПВГП, чем при изолированном проведении микронидлинга |
|
Взгляд на меланогенез с терапевтической точки зрения
За процесс выработки и распределения меланина — меланогенез — в коже отвечают эпидермальные единицы. Эти единицы состоят из меланоцитов, окруженных кератиноцитами, и регулируются замкнутой паракринной системой (рис. 2) [18].
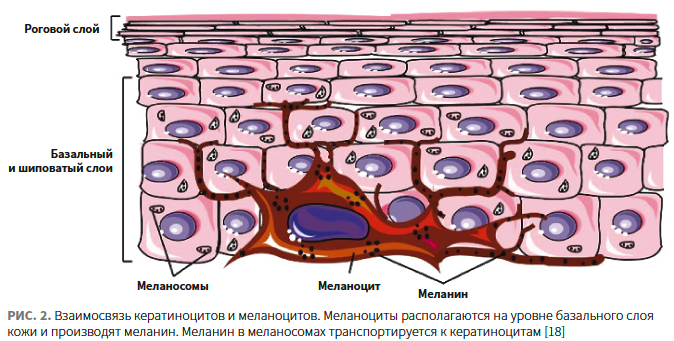
Меланин является основным фактором, определяющим цвет кожи, волос и глаз. Он также играет решающую роль в фотозащите из-за способности поглощать ультрафиолетовое (УФ) излучение. Образование пигмента происходит в меланоцитах, для этого в них существуют специальные органеллы — меланосомы.

Начальным и ключевым ферментом синтеза меланинов является медьсодержащий фермент тирозиназа, имеющий тирозин-гидроксилазную активность и ДОФА-оксидазную активность. Активность тирозиназы регулируется влияниями эйкозаноидов и эндотелина-1, которые реагируют на гормональные изменения и физические факторы (например, УФ-излучение, температурные изменения) (рис. 3).
Синтез меланинов начинается с превращения тирозина в диоксифенилаланин под влиянием тирозиназы. Далее этот же фермент образует дофахинон, и здесь пути синтеза эумеланинов и феомеланинов расходятся. В синтезе феомеланинов и придании им теплых цветовых оттенков участвует цистеин.
Наполненные меланином меланосомы продвигаются к апикальной части клетки и мигрируют в кератиноциты. В эпидермисе каждый меланоцит взаимодействует через дендриты с 30–40 кератиноцитами, обеспечивая перенос зрелых меланосом в их цитоплазму [19].
При нарушении меланогенеза могут возникнуть различные нарушения пигментации (гипо- или гиперпигментация) — с изменением числа меланоцитов или без него.
ПВГП возникает в результате перепроизводства или аномального высвобождения меланина в ответ на эндогенные или экзогенные провоспалительные стимулы. Этот процесс начинается с окисления арахидоновой кислоты с образованием эйкозаноидов, участвующих в клеточной передаче сигналов [20]. Простагландины и лейкотриены наряду с цитокинами и активными формами кислорода и азота, высвобождаемыми во время воспалительной реакции, стимулируют пролиферацию меланоцитов и усиление меланогенеза. В частности, было показано, что лейкотриен С4, лейкотриен D4, простагландин Е2, гистамин и тромбоксан В2 обладают меланоцитстимулирующими свойствами in vitro. Активация этих метаболитов связана с более высокими уровнями иммунореактивной тирозиназы, что приводит к усилению синтеза меланина и переносу меланосом в кератиноциты [21].
Очаг гиперпигментации может располагаться не только в эпидермисе. Если во время воспалительного процесса или повреждения произошло нарушение базального слоя, отложения меланина будут залегать более глубоко — на уровне дермы. При повреждении базальных кератиноцитов происходит массивный выброс меланина. Макрофаги фагоцитируют высвободившийся свободный пигмент с образованием меланофагов. Затем меланофаги располагаются в верхних слоях дермы, что проявляется в виде сине-серых пятен на месте повреждения, способных сохраняться годами [22].
Для эпидермальных очагов гиперпигментации свойственен коричневый или темно-коричневый цвет. Дермальная ПВГП чаще характеризуется более темным коричневым или сине-серым оттенком [23].
Независимо от локализации пигмента очаги ПВГП могут потемнеть или увеличиться в размерах при отсутствии контроля. Одним из триггерных факторов усугубления клинической картины ПВГП служит УФ-излучение. Как правило, эпидермальные очаги гиперпигментации исчезают в течение нескольких месяцев при адекватной коррекции. ПВГП на уровне дермы требует более продолжительной терапии, в некоторых случаях нарушения могут приобрести стойкий характер [24].
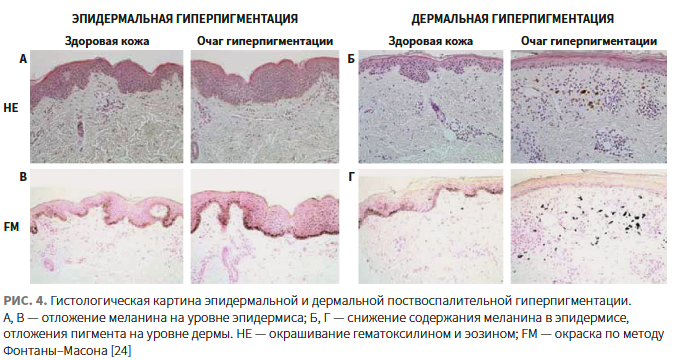
Исходя из научных публикаций, обобщенная гистологическая картина ПВГП характеризуется повышенным содержанием эпидермального меланина, меланофагов в поверхностной дерме и некоторым количеством лимфогистиоцитов, окружающих кровеносные сосуды в папиллярном слое дермы. Однако исследование Park J.Y. и соавт. выявило два различных гистопатологических паттерна ПВГП:
- эпидермальный тип — признаки усиления меланогенеза, повышение содержания меланина без изменения количества меланоцитов (рис. 4);
- дермальный тип — повышенное содержание меланина в дерме, снижение содержания меланина в эпидермисе, несмотря на усиление меланогенеза на уровне эпидермиса, значительная дермальная периваскулярная лимфоцитарная инфильтрация, более высокая экспрессия провоспалительных маркеров (CD68, рецепторной тирозинкиназы c-kit, матриксной металлопротеиназы 2), что указывает на ключевую роль воспаления в патогенезе этого типа ПВГП, в частности — инфильтрации тканей макрофагами и тучными клетками [25].
Рассматривая этапы меланогенеза, можно выделить несколько звеньев процесса, способных послужить терапевтической мишенью для предотвращения развития ПВГП:
- противовоспалительная терапия, гасящая поток стимулирующих меланогенез сигналов;
- блокирование фермента тирозиназы, предотвращающее образование меланина;
- ингибирование переноса меланосом от меланоцитов к кератиноцитам, препятствующее избыточному отложению пигмента;
- окисление синтезированного меланина, изменяющее его спектр поглощения света (меньше поглощает, больше отражает);
- ускорение клеточного обмена (отшелушивание), способствующее удалению клеток эпидермиса вместе с накопленным меланином.
Поскольку меланогенез — сложный поэтапный процесс, наиболее целесообразно применение топических средств с комплексным действием, охватывающим сразу несколько звеньев патогенеза ПВГП.
Сыворотка LIFTACTIV SPECIALIST B3 — комплексное средство для предотвращения поствоспалительной гиперпигментации
Примером комплексного средства, способного снизить риск поствоспалительной пигментации на предпроцедурном этапе, может служить сыворотка для лица LIFTACTIV SPECIALIST B3 (Vichy laboratoires, Франция). Активные ингредиенты сыворотки обеспечивают многосторонний подход к модуляции меланогенеза (табл. 2).
Таблица 2. Активные ингредиенты сыворотки LIFTACTIV SPECIALIST B3 и их влияние на патогенез поствоспалительной гиперпигментации
|
Вещество |
Биологические эффекты |
Клинические исследования |
|
Транексамовая кислота |
Является ингибитором плазмина и антифибринолитиком, предотвращает чрезмерные кровопотери после серьезных травм или ятрогенных повреждений; ингибирует активацию плазминогена, смягчая ответную реакцию кожи на действие УФ-излучения в виде пигментации (рис. 5) [26]. Свойства транексамовой кислоты:
|
При очаговой гиперпигментации легкой и средней степени тяжести топическое использование транексамовой кислоты отличалось сопоставимой эффективностью и более высоким профилем безопасности по сравнению с гидрохиноном (рис. 6, 7) [28]. Частота осложнений топической терапии составила 23% на стороне нанесения транексамовой кислоты и 51% на стороне нанесения комбинации гидрохинон + дексаметазон |
|
Ниацинамид
|
Биологически активная форма ниацина (витамина B3). Является важным компонентом коферментной системы организма. Ниацинамид необходим для многих клеточных метаболических процессов в коже — удержания влаги, поддержания липидного баланса и восстановления вызванных УФ-излучением повреждений ДНК. Дополнительно ниацинамид выполняет роль ингибитора трансфера меланосом к кератиноцитам [29] |
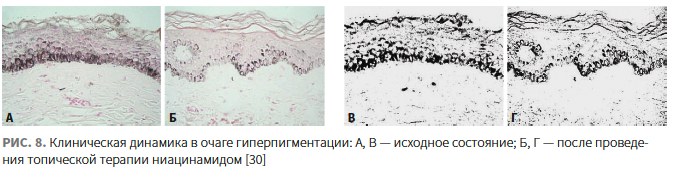
Navarrete-Solís J. и соавт. сопоставили эффект топического применения ниацинамида и гидрохинона у пациентов с мелазмой. На протяжении 18 нед пациенты наносили 4% крем ниацинамида на одну сторону лица и 4% крем гидрохинона на другую. На обеих сторонах лица пациентов наблюдалось ослабление гиперпигментации по сравнению с исходным уровнем: хорошие и отличные улучшения наблюдались в 44% случаев применения ниацинамида и 55% случаев использования гидрохинона (рис. 8). Осветляющий эффект ниацинамида был отмечен на 2-м мес топической терапии, тогда как результаты на стороне применения гидрохинона — уже в течение 1-го мес. Нежелательные явления возникали на стороне применения ниацинамида только у 18% пациентов (легкая степень тяжести), в свою очередь, на стороне применения гидрохинона — у 29% (средняя степень тяжести) [30]
|
|
Витамин C |
Аскорбиновая кислота (витамин C) оказывает важное влияние на гиперпигментацию посредством ряда механизмов:
|
16 женщин с мелазмой наносили на ночь 5% крем с аскорбиновой кислотой на одну сторону лица и крем с 4% гидрохиноном на другую сторону. Хорошие или отличные улучшения были зафиксированы у 62,5% пациентов на стороне применения аскорбиновой кислоты, у 93% — на стороне применения гидрохинона. Нежелательные явления и осложнения были зафиксированы у 68,7% пациентов на стороне применения гидрохинона и лишь у 6,2% — на стороне применения аскорбиновой кислоты. Авторы сделали вывод о целесообразности применения витамина C в составе комплексной терапии мелазмы |


В состав сыворотки также входят компоненты, не оказывающие прямого влияния на процесс меланогенеза, однако их действие способствует эффективной профилактике и разрешению гиперпигментации.
Пилинговые компоненты:
- 1,5% гликолевая кислота ослабляет сцепление между корнеоцитами, обеспечивает равномерную эксфолиацию рогового слоя, ускоряя тем самым выделение меланина;
- комплекс HEPES стимулирует активность протеаз — естественных ферментов, участвующих в десквамации рогового слоя;
- 2,2% мочевина увлажняет кожу, обеспечивает естественную эксфолиацию рогового слоя.
Действие пилинговых компонентов приводит к изменению оптических свойств рогового слоя — усилению отражения и снижению степени поглощения света.
Противовоспалительные компоненты способствуют угасанию воспаления, блокируя тем самым стимулирующие меланогенез сигналы (фермент Vitreoscilla).
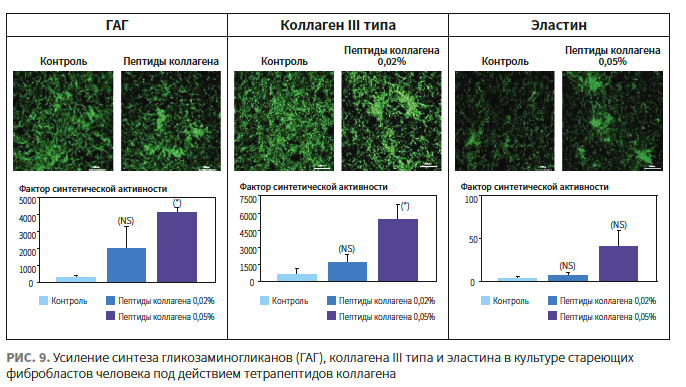
Для запуска ремоделирования и уплотнения дермы в состав сыворотки включены коллагеновые пептиды, стимулирующие синтез коллагена III типа, эластина и гликозаминогликанов (рис. 9).
Клинические исследования эффектов сыворотки LIFTACTIV SPECIALIST B3
Согласно лабораторным и клиническим исследованиям, сыворотка LIFTACTIV SPECIALIST B3 обладает следующими эффектами:
- ослабляет проявления гиперпигментации;
- выравнивает и осветляет общий тон;
- разглаживает мелкие морщины (табл. 3).
Таблица 3. Результаты клинических исследований эффектов сыворотки LIFTACTIV SPECIALIST B3
|
Выборка |
Дизайн исследования |
Результаты |
|
Женщины европеоидного типа (n = 51) в возрасте 45–65 лет с I–IVфототипами кожи. Для кожи лица характерны признаки фотостарения — морщины, неровный тон, пигментные пятна, повышенная чувствительность |
Участницы наносили несколько капель сыворотки на чистую и сухую кожу лица утром и вечером на протяжении 2 мес. Методы оценки результатов:
|
|
|
Женщины азиатского типа (n = 54) в возрасте 45–55 лет со всеми типами кожи. Для кожи лица характерны признаки фотостарения — морщины, неровный тон, пигментные пятна, повышенная чувствительность |
Участницы наносили несколько капель сыворотки на чистую и сухую кожу лица утром и вечером на протяжении 2 мес. Методы оценки результатов:
|
|
|
Женщины (n = 52) в возрасте 30–60 лет с V и VI фототипами кожи |
Участницы наносили несколько капель сыворотки на чистую и сухую кожу лица утром и вечером на протяжении 4 недель Оценка результатов осуществлялась на основе опросника (оценка пациентами достигнутых изменений) |
86% участниц отметили эффект смягчения кожи, 78% — повышение гладкости кожи, 68,3% — уменьшение выраженности морщин
|
Заключение
Риск ПВГП можно снизить путем тщательного выбора параметров терапии, особенно при наличии у пациента темного фототипа кожи.
При использовании лазеров предпочтительны более низкая плотность потока энергии и бо́льшая длительность импульса, а также более низкая плотность обработки при фракционном воздействии [2]. Дополнительно снизить вероятность развития ПВГП можно за счет уменьшения количества проходов, обеспечения дополнительного охлаждения между проходами и увеличения интервала между процедурами [32].
При проведении химических пилингов у пациентов с темными фототипами кожи следует с осторожностью выбирать уровень воздействия: при высоком риске ПВГП (темные фототипы кожи) лучше ограничиться поверхностным пилингом.
Следует также помнить, что комбинация микронидлинга и химического пилинга сопряжена с меньшим риском ПВГП.
Важным фактором снижения риска развития ПВГП после косметологических процедур является пред- и постпроцедурная топическая терапия.
Согласно ряду научных публикаций, применение топических средств, содержащих вещества — модуляторы меланогенеза, отбеливающие, отшелушивающие и противовоспалительные компоненты на этапе подготовки к процедуре позволяет снизить риск ПВГП [33]. Предпочтение следует отдавать средствам с комплексным действием. Примером такого средства может служить сыворотка LIFTACTIV SPECIALIST B3, содержащая активные ингредиенты с научно доказанным влиянием на ключевые звенья патогенеза ПВГП.
Литература
- Kaufman B.P., Aman T., Alexis A.F. Postinflammatory Hyperpigmentation: Epidemiology, Clinical Presentation, Pathogenesis and Treatment. Am J Clin Dermatol 2018; 19(4): 489–503.
- Alexis A.F., Coley M.K., Nijhawan R.I., et al. Nonablative fractional laser resurfacing for acne scarring in patients with Fitzpatrick skin phototypes IV–VI. Dermatol Surg 2016; 42(3): 392–402.
- Kono T., Chan H.H., Groff W.F., et al. Prospective direct comparison study of fractional resurfacing using different fluences and densities for skin rejuvenation in Asians. Lasers Surg Med 2007; 39(4): 311–314.
- Kang H.J., Na J.I., Lee J.H., et al. Postinflammatory hyperpigmentation associated with treatment of solar lentigines using a Q-Switched 532-nm Nd: YAG laser: a multicenter survey. J Dermatol Treat 2017; 28(5): 447–451.
- Negishi K., Akita H., Tanaka S., et al. Comparative study of treatment efficacy and the incidence of post-inflammatory hyperpigmentation with different degrees of irradiation using two different quality-switched lasers for removing solar lentigines on Asian skin. J Eur Acad Dermatol Venereol 2013; 27(3): 307–312.
- Tanzi E.L., Alster T.S. Treatment of atrophic facial acne scars with a dual-mode Er:YAG laser. Dermatol Surg. 2002; 28(7): 551–555.
- Tanzi E.L., Alster T.S. Side effects and complications of variable-pulsed erbium:yttrium-aluminum-garnet laser skin resurfacing: extended experience with 50 patients. Plast Reconstr Surg 2003; 111(4): 1524–1529.
- Nanni C.A., Alster T.S. Complications of carbon dioxide laser resurfacing. An evaluation of 500 patients. Dermatol Surg 1998; 24(3): 315–320.
- Kodali S., Guevara I.L., Carrigan C.R., et al. A prospective, randomized, split-face, controlled trial of salicylic acid peels in the treatment of melasma in Latin American women. J Am Acad Dermatol 2010; 63(6): 1030–1035.
- Abdel Meguid A.M., Elaziz Ahmed Attallah D.A., Omar H. Trichloroacetic acid versus salicylic acid in the treatment of acne vulgaris in dark-skinned patients. Dermatol Surg 2015; 41(12): 1398–1404.
- Grimes P.E. The safety and efficacy of salicylic acid chemical peels in darker racial-ethnic groups. Dermatol Surg 1999; 25(1): 18–22.
- Sarkar R., Garg V., Bansal S., et al. Comparative evaluation of efficacy and tolerability of glycolic acid, salicylic mandelic acid, and phytic acid combination peels in melasma. Dermatol Surg 2016; 42(3): 384–391.
- Salam A., Dadzie O.E., Galadari H. Chemical peeling in ethnic skin: an update. Br J Dermatol 2013; 169(Suppl 3): 82–90.
- Garg V.K., Sarkar R., Agarwal R. Comparative evaluation of beneficiary effects of priming agents (2% hydroquinone and 0.025% retinoic acid) in the treatment of melasma with glycolic acid peels. Dermatol Surg 2008; 34(8): 1032–1039.
- Majid I. Microneedling therapy in atrophic facial scars: an objective assessment. J Cutan Aesthet Surg 2009; 2(1): 26–30.
- Fabbrocini G., Fardella N., Monfrecola A., et al. Acne scarring treatment using skin needling. Clin Exp Dermatol 2009; 34(8): 874–879.
- Sharad J. Combination of microneedling and glycolic acid peels for the treatment of acne scars in dark skin. J Cosmet Dermatol 2011; 10(4): 317–323.
- D’Mello S.A., Finlay G.J., Baguley B.C., Askarian-Amiri M.E. Signaling Pathways in Melanogenesis. Int J Mol Sci 2016; 17(7): 1144.
- Fu C., Chen J., Lu J., et. Roles of inflammation factors in melanogenesis (Review). Mol Med Rep. 2020; 21(3): 1421–1430.
- Medrano E.E., Farooqui J.Z., Boissy R.E., et al. Chronic growth stimulation of human adult melanocytes by inflammatory mediators in vitro: implications for nevus formation and initial steps in melanocyte oncogenesis. Proc Natl Acad Sci USA 1993; 90(5): 1790–1794.
- Tomita .Y, Maeda K., Tagami H. Melanocyte-stimulating properties of arachidonic acid metabolites: possible role in postinflammatory pigmentation. Pigment Cell Res 1992; 5(5 Pt 2): 357–361.
- Moolla S., Miller-Monthrope Y. Dermatology: how to manage facial hyperpigmentation in skin of colour. Drugs Context 2022; 11: 2021-11-2.
- Lacz N.L., Vafaie J., Kihiczak N.I., Schwartz R.A. Postinflammatory hyperpigmentation: a common but troubling condition. Int J Dermatol 2004; 43(5): 362–365.
- Callender V.D., St Surin-Lord S., Davis E.C., Maclin M. Postinflammatory hyperpigmentation: etiologic and therapeutic considerations. Am J Clin Dermatol 2011; 12(2): 87–99.
- Park J.Y., Park J.H., Kim S.J., et al. Two histopathological patterns of postinflammatory hyperpigmentation: epidermal and dermal. JCutan Pathol 2017; 44(2): 118–124.
- Моя специальность — косметология. Пигментация в практике косметолога. Под общ. ред. Е.И. Эрнандес., Е.М. Раханской. М.: ИД «Косметика и медицина», 2020.
- Taraz M., Niknam S., Ehsani A.H. Tranexamic acid in treatment of melasma: a comprehensive review of clinical studies. Dermatol Ther 2017; 30(3).
- Ebrahimi B., Naeini F.F. Topical tranexamic acid as a promising treatment for melasma. J Res Med Sci 2014; 19(8): 753–757.
- Hakozaki T., Minwalla L., Zhuang J., et al. The effect of niacinamide on reducing cutaneous pigmentation and suppression of melanosome transfer. Br J Dermatol 2002; 147(1): 20–31.
- Navarrete-Solís J., Castanedo-Cázares J.P., Torres-Álvarez B., et al. A double-blind, randomized clinical trial of niacinamide 4% versus hydroquinone 4% in the treatment of melasma. Dermatol Res Pract 2011; 2011: 379173.
- Murphy M.J., Dow A.A. Natural Cosmeceutical Ingredients for the Management of Hyperpigmentation in Hispanic and Latino Women. J Clin Aesthet Dermatol 2021; 14(8): 52–56.
- Kaushik S.B., Alexis A.F. Nonablative fractional laser resurfacing in skin of color: evidence-based review. J Clin Aesthet Dermatol 2017; 10(6): 51–67.
- Cheyasak N., Manuskiatti W., Maneeprasopchoke P., Wanitphakdeedecha R. Topical corticosteroids minimise the risk of postinflammatory hyper-pigmentation after ablative fractional CO2 laser resurfacing in Asians. Acta Derm Venereol 2015; 95(2): 201–205.