НОРМАЛИЗАЦИЯ МИКРОБИОМА КОЖИ — ВАЖНЫЙ ЭТАП РЕАБИЛИТАЦИИ ПОСЛЕ МАЛОИНВАЗИВНЫХ ПРОЦЕДУР
19.09.2022
Чеботарева Юлия Юрьевна
Врач дерматовенеролог, косметолог, главный врач клиники Эстелаб, член Американского общества лазерной медицины и хирургии (ASLMS), KOL CoolSculpting by Allergan, сертифицированный тренер компании Syneron Candela, IPSEN, GALDERMA
Контролируемое повреждение посредством различных физических факторов является одним из основных механизмов, используемых в косметологии с целью запуска ремоделирования и омоложения кожи. Однако для успешного завершения процесса регенерации необходимо создать благоприятные условия.
С целью формирования научно обоснованного эффективного подхода к лечению ран в 2002 г. была разработана концепция TIME. Принципы концепции фокусируют внимание специалистов на основных аспектах ухода за раной, обеспечивающих благоприятную регенерацию:
- T (Tissue debridement; обработка тканей) — удаление некротических и/или омертвевших тканей и фибринозного налета;
- I (Infection or inflammation; инфекция или воспаление) — контроль за воспалительным и инфекционным процессом, профилактика и лечение раневой инфекции;
- M (Moisture balance; поддержание оптимальной влажности) — обеспечение достаточной степени гидратации раневого ложа и устранение избытка экссудата;
- E (Edgless; края раны, эпителизация) — создание микроокружения раневого ложа, способствующего заживлению на клеточном уровне [1].
Как можно убедиться, модуляция воспалительного процесса и предотвращение инфицирования являются приоритетными условиями нормального заживления поврежденных тканей.
К решению этих задач мы можем привлечь невидимого, но очень сильного союзника — микробиом кожи.
Роль микробиома в поддержании здоровья кожи
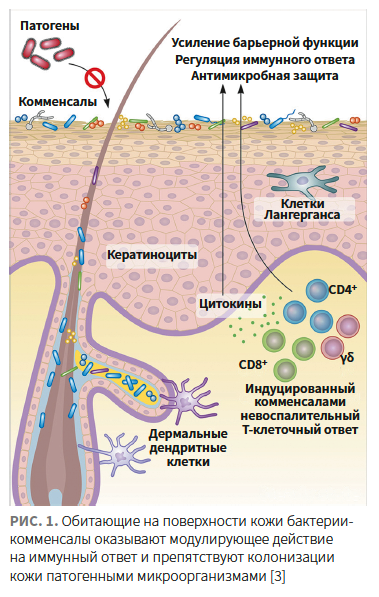
Являясь основным форпостом нашего организма, кожа функционирует в тесной взаимосвязи с обитающими на ее поверхности микроорганизмами (кожным микробиомом), численность которых на 1 см2 кожи может превышать 1 млн.
Они участвуют в ее защите от патогенных микроорганизмов и поддержании гомеостаза — влияют на пролиферацию кератиноцитов, дифференцировку эпителия и рост кровеносных сосудов, а также тесно взаимодействуют с иммунной системой (рис. 1) [3].
Сообщество бактерий-комменсалов кожи формируется в тесной связи с иммунной системой организма-хозяина для обеспечения симбиотических (полезных для обеих сторон) отношений.
В раннем возрасте колонизация кожи новорожденных бактериями-комменсалами способствует развитию иммунной системы и специфической толерантности к комменсалам. Эта иммунная толерантность зависит от регуляторных Т-клеток (Treg), основная функция которых — контролировать силу и продолжительность иммунного ответа [4].
Иными словами, иммунная система воспринимает представителей здорового микробиома как «своих» и не реагирует на их присутствие, в свою очередь, появление патогенных бактерий на поверхности кожи вызывает иммунный ответ в виде воспаления.
В случаях нарушения или ослабления эпидермального барьера кожный микробиом может сыграть роль важного фактора, способного направить процесс регенерации по благоприятному пути или, наоборот, — запустить развитие различных кожных заболеваний.
Какую пользу приносят бактерии-комменсалы?
1. Сохраняют структурную целостность эпидермального барьера
Между клетками рогового слоя располагаются слои липидов, отделенных тонкой водной прослойкой, по которой вода перемещается по направлению к поверхности — этот процесс называется трансэпидермальной потерей воды (ТЭПВ).
Здоровой коже свойственен сбалансированный состав межклеточных липидов — пропорция «церамиды/холестерин/свободные жирные кислоты» 1 : 1 : 1. В случае изменения пропорции происходит нарушение всей структуры липидного барьера, что влечет ослабление барьерной функции рогового слоя в целом и усиление потери воды.
Для образования церамидов необходима сфингомиелиназа. Этот фермент секретирует кожный комменсал S. epidermidis, способствуя тем самым гомеостазу и сохранению целостности кожного барьера [5].
2. Препятствуют колонизации кожи патогенными микроорганизмами

Представители здорового микробиома кожи конкурируют с патогенными бактериями за питательные вещества и среду обитания [3]. Многие комменсалы, в том числе C. acnes, S. epidermidis и Malassezia spp., формируют неблагоприятные для патогенных микроорганизмов условия путем ацидификации (т.е. снижения pH) поверхности кожи. Кислая среда также является необходимым условием нормального функционирования ферментных систем кожи [6].
Здоровая микрофлора вносит непосредственный вклад в устойчивость к колонизации кожи патогенными бактериями за счет синтеза собственных антимикробных молекул [3].
Согласно исследованиям, S. epidermidis, S. hominis и S. lugdunensis выделяют молекулы, которые убивают или препятствуют колонизации S. aureus. Кроме того, S. epidermidis может ингибировать образование биопленки S. aureus за счет продукции сериновой протеазы глутамилэндопептидазы (Esp) (рис. 2) [7, 8].
3. Модулируют иммунный ответ
Комменсалы индуцируют выработку антимикробных пептидов (АМП) кератиноцитами кожи. S. epidermidis активирует сигнальный путь TLR2. Это приводит к повышению экспрессии АМП (например, hbD2, hbD3) кератиноцитами, что, в свою очередь, способствует заживлению ран и модулирует эффективный воспалительный ответ [3].
Также было продемонстрировано, что комменсалы кожи регулируют воспалительную реакцию с помощью различных механизмов для заживления кожи после повреждения.
S. epidermidis синтезирует ряд веществ, определяющих течение иммунного ответа:
- липотейхоевую кислоту — ингибирует высвобождение провоспалительных цитокинов из кератиноцитов, а также воспалительную реакцию в ответ на повреждение посредством TLR2-зависимого механизма [8, 9];
- липопептид 78 (LP78) — ингибирует опосредованное TLR3 воспаление кожи, способствуя заживлению ран [10].
Еще один важный механизм усиления иммунной защиты, в котором участвует S. epidermidis, — это активация эпидермальных Т-клеток с фенотипом CD8+. Таким образом происходит усиление врожденного иммунного ответа, ограничение инвазии патогенов, а также ускорение заживления раны [11].
Топическое применение про- и пребиотических средств для улучшения состояния кожи
Большинство бактериальных экстрактов для топического применения представляют собой ферменты, лизаты ферментов или их фильтраты, получаемые после культивирования и сбора пробиотических микроорганизмов.
Согласно лабораторным и клиническим исследованиям, топические средства, содержащие инактивированные пробиотические штаммы, способствуют заживлению ран и улучшают течение ряда распространенных дерматозов (рис. 3) [12, 13].
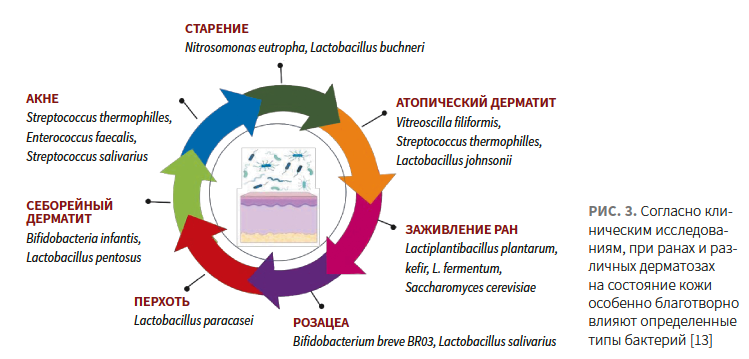
Lopes E.G. и соавт. определили наличие антибактериальных свойств в отношении патогенов у экстрактов Bacillus coagulans, L. johnsonii, L. casei, L. plantarum и L. acidophilus, которые могут способствовать заживлению кожи [14].
Результаты исследования Lim H.Y. засвидетельствовали еще один благотворный эффект экстракта Lactobacillus acidophilus — способность поглощать активные формы кислорода после вызванного УФ-В окислительного стресса в кератиноцитах [15].
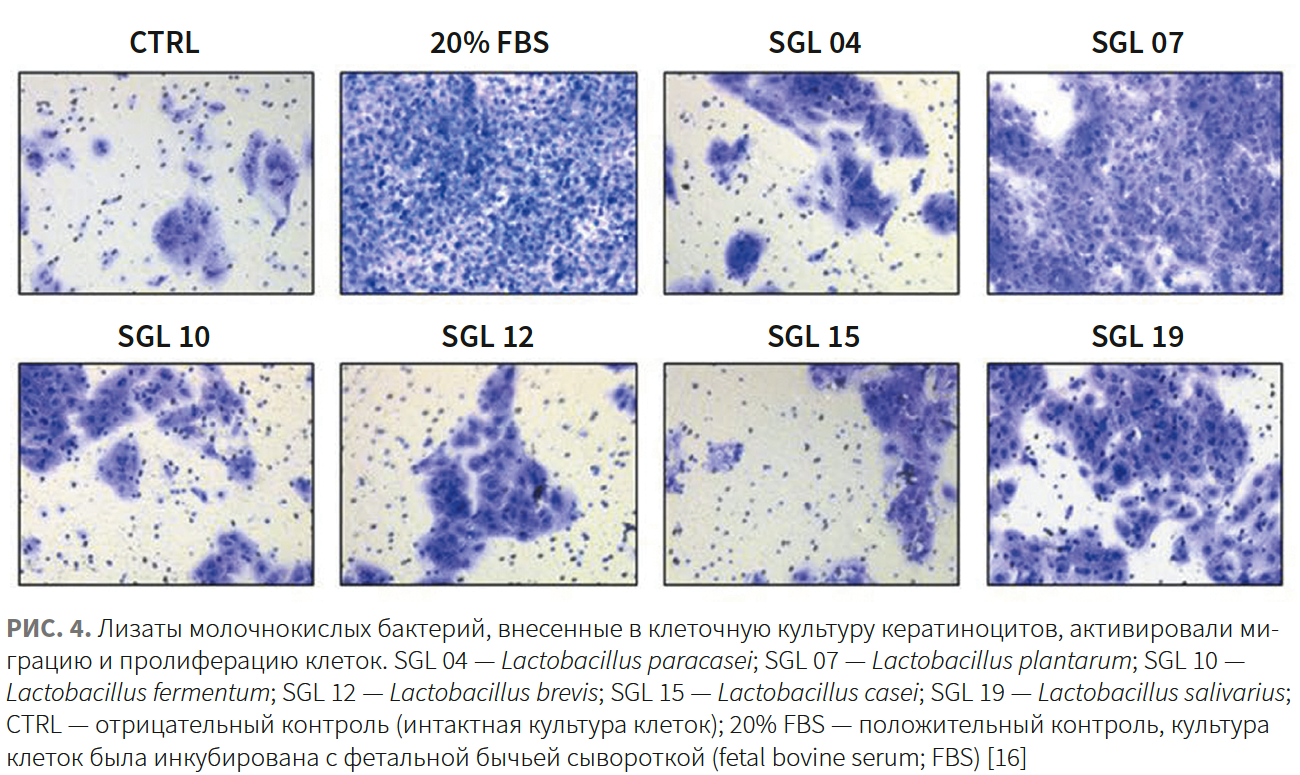
Топическое применение лизатов Lactobacillus plantarum и L. salivarius ускоряло реэпителизацию за счет индукции перемещения кератиноцитов [16].
Улучшение барьерной функции реконструированного эпидермиса человека наблюдалось после применения лизатов L. rhamnosus. Топическое нанесение экстракта S. thermophilus способствовало усилению выработки церамидов и повышению гидратации кожи [17, 18].
Экстракт Vitreoscilla filiformis посредством активации TLR2 усиливал врожденный иммунитет и барьерную функцию, что приводило к ослаблению симптомов атопического и себорейного дерматита [19].
Используя экстракт Bifidobacterium longum, Guéniche A. и соавт. продемонстрировали сначала in vitro, а затем в ходе клинических исследований, что нанесение инактивированного штамма бактерий в составе топического средства на чувствительную кожу способно улучшить ее состояние [20]. Используя ex vivo модель эксплантата кожи человека, авторы обнаружили статистически значимое уменьшение выраженности параметров, связанных с воспалением, таких как вазодилатация, отек, дегрануляция тучных клеток и высвобождение ФНО-α по сравнению с плацебо.
На втором этапе исследования нервные клетки инкубировали in vitro в среде с пробиотическим лизатом. Через 6 ч было отмечено выраженное ингибирование вызванного капсаицином высвобождения нервными клетками CGRP (нейропептида, медиатора боли).
Местное применение лизатов молочнокислых бактерий (МКБ), помимо их прямого положительного воздействия на кожу (противовоспалительное действие, активация пролиферации кератиноцитов и реэпителизации), препятствует колонизации кожи такими патогенными бактериями, как S. aureus и S. pyogenes. Понижение pH за счет молочной кислоты также создает благоприятные условия для основного комменсала кожи — S. epidermidis [21].
Результаты исследования свидетельствует о перспективах применения пробиотических топических средств для уменьшения чувствительности кожи, а также раздражения после химических пилингов и малоинвазивных аппаратных процедур [22, 23].
Применение бальзама CICAPLAST BAUME B5+ для реабилитации после малоинвазивных косметологических процедур
Для восстановления кожи после повреждения Дерматологическая лаборатория La Roche-Posay разработала бальзам CICAPLAST BAUME B5+, отвечающий основным принципам концепции заживления ран TIME.
Комплекс Tribioma, ключевой компонент бальзама, направлен на формирование благоприятного для регенерации ткани микроокружения — здорового микробиома (табл. 1).
Таблица 1. Запатентованный пребиотический комплекс Tribioma
|
Ecoskin® |
Манноза |
||
|
Инактивированные штаммы L. casei и L. acidophilus |
Растительный экстракт якона (Smallanthus sonchifolius) — источник фруктоолигосахаридов, обладающих пребиотическими свойствами, и полифенолов |
α-Глюкоолигосахарид — биоселективный пребиотик, полученный путем ферментации натуральных сахаров (сахарозы и мальтозы), стимулирует рост и жизнедеятельность нормальной микрофлоры |
Моносахарид, изомер глюкозы, служит питательной средой для бактерий, стимулирует рост и жизнедеятельность нормальной микрофлоры |
Входящие в состав комплекса Tribioma олигосахариды являются биоселективной питательной средой для здорового микробиома кожи (табл. 2).
Таблица 2. Ecoskin® — биоселективная среда для здорового микробиома.
|
Микроорганизм |
Ecoskin® |
Глюкоза |
|
Комменсалы |
||
|
Lactobacillus pentosus |
+++ |
+++ |
|
Micrococcus kristinae |
+++ |
+++ |
|
Corynebacterium xerosis |
++ |
+++ |
|
Staphylococcus capitis |
+ |
+++ |
|
Патогенная флора |
||
|
Gardenella vaginalis |
− |
+ |
|
Corynebacterium minutissimum |
− |
+++ |
|
Staphylococcus aureus |
− |
+++ |
В их присутствии создаются условия для прогрессивного увеличения численности бактерий-комменсалов и конкурентного подавления патогенной флоры (табл. 3).
Таблица 3. Результаты культивирования комменсальной (M. kristinae) и патогенной (S. aureus) флоры в среде с α-глюкоолигосахаридами (0,5%) на протяжении 24 ч
|
|
Общее количество |
S. aureus |
M. kristinae |
|
Тест 1 |
108 |
˂ 3,7 × 104 |
˃ 107 |
|
Тест 2 |
3,7 × 108 |
˂ 5 × 105 |
˃ 5 × 107 |
|
Тест 3 |
108 |
˂ 5 × 104 |
˃ 107 |
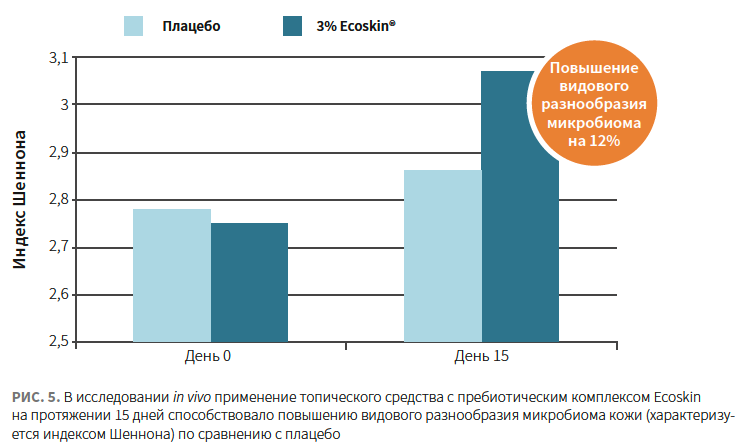
Согласно исследованию in vivo с участием 10 пациентов в возрасте 22–54 лет, применение топического средства, содержащего Ecoskin 3%, 2 р/день на протяжении 15 дней привело к повышению бактериального разнообразия (характеризуется индексом Шеннона) без увеличения плотности колонизации кожи (рис. 4).
Механизм усиления иммунной защиты при использовании Ecoskin 3% также заключается в активации сигнальных путей толл-подобных рецепторов (TLR2 и TLR4), обеспечивающих функционирование врожденного иммунитета, а также в стимуляции синтеза антимикробных пептидов кератиноцитами (рис. 5).
Еще один пребиотический компонент бальзама CICAPLAST BAUME B5+ — это Aqua posae filiformis, представляющий собой лизат бактерий Vitreoscilla filiformis (VF), выращенных в термальной воде La Roche-Posay.
В отличие от других видов термальной воды, La Roche-Posay содержит селен (0,053 мг/л) и стронций (0,3 мг/л), выполняющие функцию катализаторов бактериальных ферментов. Внесение в среду обитания VF термальной воды La Roche-Posay значительно усиливает активность микроорганизмов (Super VF).
Super VF инактивируют путем кипячения и фрагментации для предотвращения неконтролируемой бактериальной пролиферации.
Aqua posae filiformis обладает высокой биологической активностью благодаря веществам, содержащимся в лизате Super VF:
- оказывает иммуномодулирующее действие — путем взаимодействия с TLR2 способствует толерантности иммунной системы к бактериям-комменсалам и эффективному иммунному ответу на присутствие патогенных микроорганизмов [23, 24];
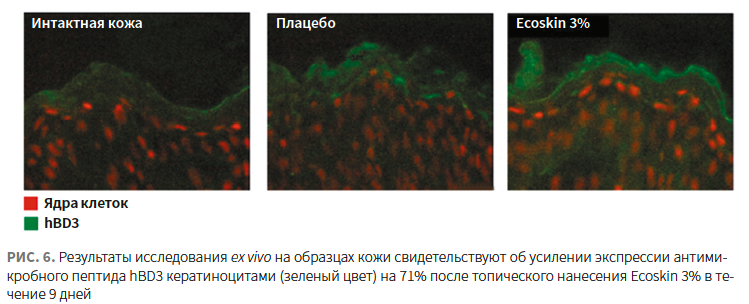
- усиливает синтез антимикробных пептидов в коже (рис. 6) [25];
- успокаивает нейрогенное воспаление, вызванное субстанцией P [26];
- стимулирует пролиферацию кератиноцитов, увеличивает количество плотных контактов, способствуя прочной когезии клеток, ускоряет обновление рогового слоя [27];
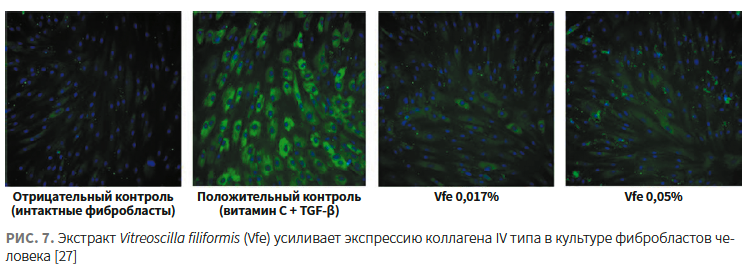
- активирует синтез коллагена I и IV типа (рис. 7) [27].
Согласно клиническому исследованию с участием 22 пациентов в возрасте 22–70 лет, топическое нанесение 1% Aqua posaefiliformis после гликолевого пилинга способствовало благоприятному течению постпроцедурного реабилитационного периода:
- снизилась выраженность эритемы и отека;
- ощущения зуда, жжения и стянутости стали значительно слабее;
- через 1 день после процедуры пилинга 86% пациентов отметили регресс признаков повышенной чувствительности кожи.
Действие ряда основных ингредиентов бальзама CICAPLAST BAUME B5+ направлено также на модуляцию благоприятного для заживления раны иммунного ответа, купирование воспаления, восстановление эпидермального барьера (табл. 4).
Таблица 4. Активные ингредиенты бальзама CICAPLAST BAUME B5+, обеспечивающие восстановление эпидермального барьера, повышение гидратации кожи, купирование избыточного воспаления и нормализацию пролиферации кератиноцитов
|
Активные ингредиенты |
Биологические эффекты |
|
Пантенол (пантотеновая кислота, витамин B5) |
|
|
Цинк и глюконат марганца |
|
|
Мадекассосид(Madecassoside) — изолят из Centella asiatica |
|
|
Глицерин |
|
|
Масло ши (карите) |
|
Влияние топического применения бальзама CICAPLAST BAUME B5+ на течение восстановительного периода после малоинвазивных косметологических процедур, а также на процесс заживления после повреждения кожи в результате травмы или ожога было оценено в ряде клинических исследований (табл. 5).
Таблица 5. Клинический опыт применения бальзама CICAPLAST BAUME B5+ после малоинвазивных косметологических процедур и повреждения кожи
|
Дизайн исследования |
Результаты |
|
|
|
|
|
|
|
|
Заключение
Формирование здорового микробиома — новый уровень заботы о здоровье кожи. Топические средства с пребиотическими свойствами позволяют создать благоприятную для бактерий-комменсалов микросреду. Таким образом, мы приобретаем союзника, который будет «лоббировать интересы» нашей кожи на нескольких уровнях. С одной стороны — поддерживать целостность эпидермального барьера, модулировать иммунный ответ и процессы пролиферации кератиноцитов, с другой — противостоять колонизации кожи патогенными микроорганизмами.
В случае повреждения кожи микробиом может сыграть роль важного фактора, способного направить процесс регенерации по благоприятному пути.
Бальзам CICAPLAST BAUME B5+ содержит ряд пребиотических компонентов, создающих благоприятные условия для комменсальной флоры. Ряд активных ингредиентов бальзама направлен на купирование избыточного воспаления, ослабление повышенной чувствительности кожи и восстановление ее гидратации. Все это является залогом успешной регенерации кожи и позволяет применять бальзам для эффективного восстановления после малоинвазивных косметологических процедур.
Литература
- Tottoli E.M., Dorati R., Genta I., et al. Skin Wound Healing Process and New Emerging Technologies for Skin Wound Care and Regeneration. Pharmaceutics 2020; 12(8): 735.
- Pistone D., Meroni G., Panelli S., et al. A Journey on the Skin Microbiome: Pitfalls and Opportunities. Int J Mol Sci 2021; 22(18): 9846.
- Swaney M.H., Kalan L.R. Living in Your Skin: Microbes, Molecules, and Mechanisms. Infect Immun 2021; 89(4): e00695–20.
- Belkaid Y., Segre J. A. Dialogue between skin microbiota and immunity. Science 2014; 346(6212): 954–959.
- Zheng Y., Hunt R.L., Villaruz A.E., et al. Commensal Staphylococcus epidermidis contributes to skin barrier homeostasis by generating protective ceramides. Cell Host Microbe 2022; 30(3): 301–313.e9.
- Rippke F., Berardesca E., Weber T.M. pH and Microbial Infections. Curr Probl Dermatol 2018; 54: 87–94.
- Chen Y.E., Fischbach M.A., Belkaid Y. Skin microbiota-host interactions. Nature 2018; 553(7689): 427–436.
- Byrd A., Belkaid Y., Segre J. The human skin microbiome. Nat Rev Microbiol 2018; 16(3): 143–155.
- Lai Y., Di Nardo A., Nakatsuji T., et al. Commensal bacteria regulate Toll-like receptor 3-dependent inflammation after skin injury. Nat Med 2009; 15(12): 1377–1382.
- Li D., Wang W., Wu Y., et al. Lipopeptide 78 from Staphylococcus epidermidis Activates β-Catenin To Inhibit Skin Inflammation. J Immunol 2019; 202(4): 1219–1228
- Harrison O.J., Linehan J.L., Shih H.-Y., et al. Commensal-specific T cell plasticity promotes rapid tissue adaptation to injury. Science 2019; 363(6422): eaat6280.
- Habeebuddin M., Karnati R.K., Shiroorkar P.N., et al. Topical Probiotics: More Than a Skin Deep. Pharmaceutics 2022; 14(3): 557.
- Petrov A., Ćorović M., Milivojević A., et al. Prebiotic effect of galacto-oligosaccharides on the skin microbiota and determination of their diffusion properties. Int J Cosmet Sci 2022; 44(3): 309–319.
- Lopes E.G., Moreira D.A., Gullón P., et al. Topical application of probiotics in skin: Adhesion, antimicrobial and antibiofilmin vitroassays. J Appl Microbiol 2017; 122(2): 450–461.
- Lim H.Y., Jeong D., Park S.H., et al. Antiwrinkle and Antimelanogenesis Effects of Tyndallized Lactobacillus acidophilusKCCM12625P. Int J Mol Sci 2020; 21(5): 1620.
- Brandi J., Cheri S., Manfredi M., et al. Exploring the wound healing, anti-inflammatory, anti-pathogenic and proteomic effects of lactic acid bacteria on keratinocytes. Sci Rep 2020; 10(1): 11572.
- Jung Y.-O., Jeong H., Cho Y., et al. Lysates of a Probiotic, Lactobacillus rhamnosus, Can Improve Skin Barrier Function in a Reconstructed Human Epidermis Model. Int J Mol Sci 2019; 20(17): 4289.
- Dimarzio L., Cinque B., Cupelli F., et al. Increase of Skin-Ceramide Levels in Aged Subjects following a Short-Term Topical Application of Bacterial Sphingomyelinase from Streptococcus Thermophilus. Int J Immunopathol Pharmacol 2008; 21(1): 137–143.
- Volz T., Skabytska Y., Guenova E., et al. Nonpathogenic bacteria alleviating atopic dermatitis inflammation induce IL-10-producing dendritic cells and regulatory Tr1 cells. J Investig Dermatol 2014; 134(1): 96–104.
- Guéniche A., Bastien P., Ovigne J.M., et al. Bifidobacterium longum lysate, a new ingredient for reactive skin. Exp Dermatol. 2010; 19(8): e1–e8.
- Nodake Y., Matsumoto S., Miura R., et al. Pilot study on novel skin care method by augmentation with Staphylococcus epidermidis, an autologous skin microbe — A blinded randomized clinical trial. J Dermatol Sci 2015; 79(2): 119–126.
- Gehring W., Gloor M. Effect of topically applied dexpanthenol on epidermal barrier function and stratum corneum hydration. Results of a human in vivo study. Arzneimittelforschung 2020; 50(7): 659–663.
- Baron J.M., Glatz M., Proksch E. Optimal Support of Wound Healing: New Insights. Dermatology 2020; 236(6): 593–600.
- Mahe Y.F., Perez M.-J., Tacheau C., et al. New Vitreoscilla filiformis extract grown on spa water-enriched medium activates endogenous cutaneous antioxidant and antimicrobial defenses through a potential Toll-like receptor 2/protein kinase C, zeta transduction pathway. Clin Cosmet Investig Dermatol 2013; 30(6): 191–196.
- Mahé Y., Martin R. Use of a lipopolysaccharide fraction of Vitreoscilla filiformis as agent for stimulating the synthesis of antimicrobial peptides on the skin. Patent FR-2914189-A1. Priority Date 2007/03/26. Filing Date 2007/03/26. Publication Date.2008/10/03.
- Li L., Jun H., Dawei Z., et al. Evaluation of the Efficacy and Skin Tolerance of a Cream Containing 1% Vitreoscilla Filiformis Extract Applied on Chinese Women With Sensitive Skin. Chin J Med Aesthetics Cosmetol 2006; 12: 195–197.
- Gueniche A., Liboutet M., Cheilian S., et al. Vitreoscilla filiformis Extract for Topical Skin Care: A Review. Front Cell Infect Microbiol 2021; 11: 747663.
- Gorski J., Proksch E., Baron J.M., et al. Dexpanthenol in Wound Healing after Medical and Cosmetic Interventions (Postprocedure Wound Healing). Pharmaceuticals 2020; 13(7): 138.
- Shahriari-Khalaji M., Hong S., Hu G., et al. Bacterial Nanocellulose-Enhanced Alginate Double-Network Hydrogels Cross-Linked with Six Metal Cations for Antibacterial Wound Dressing. Polymers 2020; 12(11): 2683.
- Tan C., Bhattamisra S.K., Chellappan D.K., Candasamy M. Actions and Therapeutic Potential of Madecassoside and Other Major Constituents of Centella asiatica: A Review. Appl Sci 2021; 11(18): 8475.
Статья опубликована в журнале «Косметика и медицина Special Edition 2022» №3/2022
На правах рекламы